マサチューセッツ州ダンバース--(BUSINESS WIRE)--(ビジネスワイヤ) --アビオメッド(Nasdaq: ABMD)は、急性心筋梗塞に伴う心原性ショック患者におけるImpella心臓ポンプの臨床研究に関して米国食品医薬品局(FDA)の2つの承認を得たことを発表しました。
FDAは、急性心筋梗塞に伴う心原性ショック患者を対象としたオンラベルのRECOVER IVランダム化比較試験(RCT)を承認しました。RECOVER IVは、Impellaによる補助を開始しその後経皮的冠動脈インターベンション(PCI)を行う症例と、Impellaによる補助なしにPCIを行う症例を比較する2群間比較試験です。
Henry Ford Healthのthe Center for Structural Heart Diseaseのメディカルディレクターで、RECOVER IVの国内共同治験責任医師のWilliam O’Neill医師は次のように述べています。「この画期的な試験は、急性心筋梗塞のインターベンション治療における20年以上の研究の集大成であり、複数の前向き研究で示された心原性ショックを有する急性心筋梗塞患者の生存と心機能回復を改善するための臨床的な知見をすべて適用して実施されるものです。」
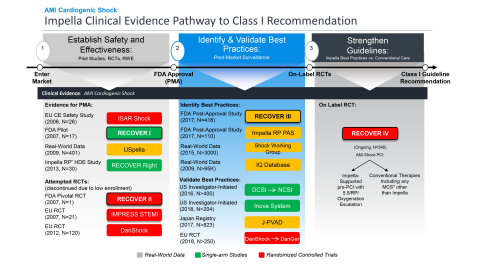
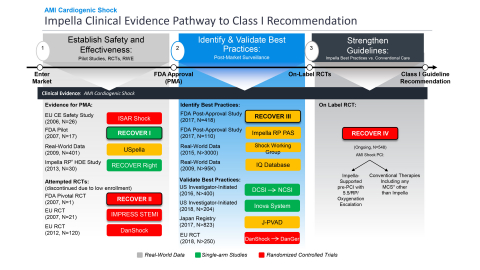
RECOVER IVの主要評価項目は、30日の全死亡率です。副次的評価項目は、30日の主要有害心血管・脳血管イベント(MACCE)、6カ月後の生存退院日数、左室(LV)機能の回復、植込み型補助人工心臓(VAD)または心臓移植の必要性、1年後のKansas City Cardiomyopathy Questionnaire (KCCQ)による健康関連QOLとなっています。アビオメッドの本試験実施の目的は、全世界的な急性心筋梗塞に伴う心原性ショック治療に対するガイドラインにおいて、Impellaの使用ならびにPCI前のImpella留置を含むベストプラクティスに対するClass Iの推奨を達成することです。
Tufts Medical Centerのthe Cardiovascular Center for Research and Innovation (CVCRI)のエグゼクティブディレクターでRECOVER IVの国内共同治験責任医師のNavin K. Kapur医師は、次のように述べています。「RECOVER IVが血行動態のサポートとベストプラクティスのプロトコルの有用性をさらに実証してくれるものと期待しています。これらの利点には、PCI前のImpellaによる心室アンロード、LV壁ストレスの軽減、肺うっ血の軽減、側副血行路血流の増加、心筋保護の強化などがあり、より多くの急性心筋梗塞に伴う心原性ショック患者が生存し、自己心機能の回復を達成することができるようになります。ハートチームやその他のスタッフは、心不全という深刻な状況を減らすために急性心筋梗塞、そしてそれに伴う心原性ショック両方の病態において心筋回復がいかに重要であるか理解を深めてきました。」
FDAがRECOVER IIIの承認後試験を承認・終了
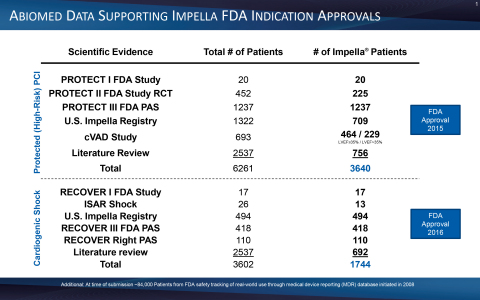
また、FDAはImpellaの前向き試験である急性心筋梗塞に伴う心原性ショックの事後評価試験(PAS)であるRECOVER IIIを承認し、終了させました。この研究は、2017年から2019年にかけてImpellaで治療した急性心筋梗塞に伴う心原性ショック患者に関するリアルワールドエビデンスを収集し、心原性ショックのステージ、心拍出量、留置のタイミングを含む詳細データを収集しました。RECOVER IIIはアビオメッドのPAS要件を満たしており、FDAによるRECOVER IIIの承認と終了は、急性心筋梗塞に伴う心原性ショックに対する安全かつ有効な治療法としてのImpellaをさらに検証するものです。
急性心筋梗塞に伴う心原性ショックの臨床的経緯
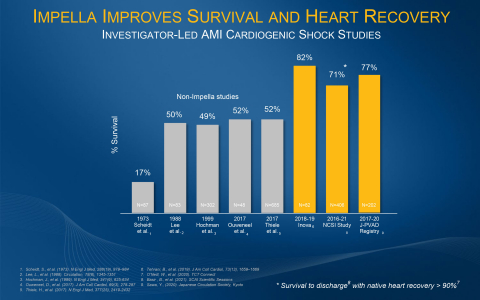
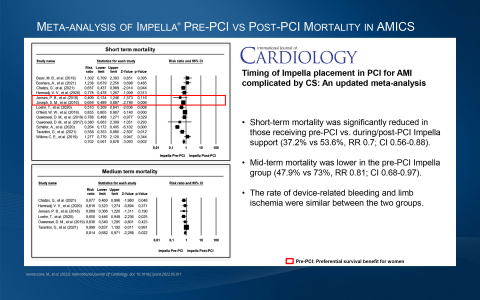
心筋梗塞による心原性ショックは、医学の分野では最も死亡率の高い疾患の一つです。SCAIが定めるStage DおよびEの心原性ショック患者の生存率は、Impellaのサポートや関連するベストプラクティスがなければ約50%に留まっています。心原性ショックにおける生存率だけでは、もはやゴールドスタンダードとは言えません。複数のImpellaのベストプラクティスの研究では、生存率70%以上、心筋の回復率は90%以上であることが証明されています。PCI前留置などのImpellaのベストプラクティスは、循環補助の分野で認められた医師の専門家によって開発され、米国、ドイツ、イタリア、日本からの複数の臨床研究で過去10年間に発表されています。急性心筋梗塞に伴う心原性ショック後の心臓回復により、患者のQOLが向上し、ImpellaはCMSメディケア患者や民間保険において最も費用対効果の高い治療法の一つとなっています。米国だけでも、毎年20万人以上の患者さんが心原性ショックで入院しています。
急性心筋梗塞に伴う心原性ショックに関するFDA規制の歴史
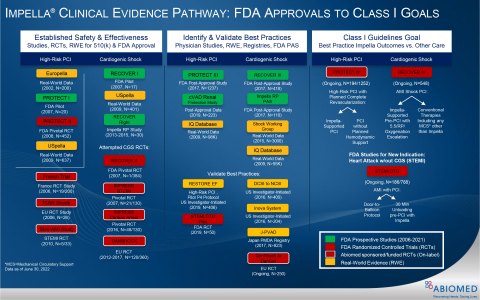
ImpellaはFDAの歴史の中で最も多く研究された心臓ポンプで、心原性ショック、高リスクPCI、および右心不全に対して安全かつ有効な治療法としてFDA PMAに独占的に承認されています。2004年以降、Impella の臨床的有用性について、リアルワールドエビデンスの分析、前向き臨床研究、RCT を含む 1,200 以上の査読済み研究が発表されています。Impella は世界中で235,000人以上の患者さんの治療に使用されており、13の臨床学会ガイドラインに記載されています。2021年、欧州心臓病学会は、Impellaを心原性ショックの治療に対するクラスIIa推奨に格上げしました。
大動脈内バルーン (IAB)は現在、IABP-SHOCK II RCTに基づいてヨーロッパと日本で心原性ショックへのルーチン使用はクラス III(有害) に分類され、強心剤での治療と比較してIABは生存または血行動態の増強にメリットがないことが実証されました。
2020年、IABは米国の開心術後の心原性ショックに関するガイドライン推奨でクラスIII(有害) になりました。
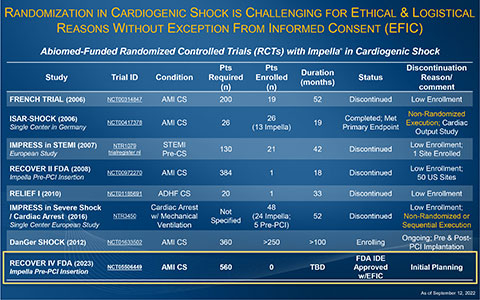
1992年以降のすべてのMCSおよび補助人工心臓(VAD)は、単一群の試験で承認されており、客観的性能基準(OPC)で判断された過去の生存率と比較されています。これは、即時の血行動態の増強を必要とする重症患者をランダム化するという倫理的およびロジスティクス上の課題によるものです。2008 年と 2009 年に、アビオメッドは、心筋梗塞に伴う心原性ショックにおけるImpellaと IAB を比較するFDA RECOVER II RCTを試みました。RECOVER II は、15か月間で30以上の施設のうち1人の患者さんのみを登録しましたが、ロジスティクスおよび倫理上の同意の問題と登録患者数の不足のために中止されました。
FDAは2008 年にImpellaに510(k)認可を付与し、複数の FDA 試験および前向き医師主導試験の後、FDA は 2015 年に高リスク PCI、2016 年に急性心筋梗塞に伴う心原性ショック(図 6 を参照)、2018年に心原性ショックを伴うその他の病態の心不全を承認しました。RECOVER IIIの達成とRECOVER IV RCTの承認により、アビオメッドはグローバルガイドラインを強化し、患者さんの予後を改善するためのオンラベル研究を進めています。
アビオメッドは2006 年以来、この分野で唯一のFDA研究を含む、複数の急性心筋梗塞に伴う心原性ショックの研究 をサポートし、資金を提供してきました。急性心筋梗塞に伴う心原性ショック患者をランダム化することの難しさは、IMPRESS in STEMI (n=18)、IMPRESS in Cardiac Arrest (n=48)、Seyfarth, et al. (n=26) およびアビオメッドがサポートするFDA RECOVER II RCT(n=1)等含む複数の研究で示されています。これらの研究はすべてランダム化に失敗し、ロジスティックと倫理的な同意の問題に基づいて指定された患者数を登録できなかったため、早期に中止されました。
インフォームド・コンセントの例外(EFIC)に関する最近の FDA 規制の変更:
急性心筋梗塞に伴う心原性ショックの患者さんのランダム化は、緊急の治療を必要とし従来のインフォームド・コンセントを得ることができないため困難とされてきました。1996年に、FDA は緊急臨床研究のためのインフォームド・コンセントの例外(EFIC)を創設しました。この制度により、治験責任医師は地域社会に広く試験について説明し、患者さんやその家族、法的に認められた代理人からの同意なしで患者さんを登録することができるようになりました
2022年、FDAとRECOVER IV RCT試験デザインについて協議した後、FDAはEFICの使用を含むRECOVER IV RCT研究プロトコルを承認しました。このコミュニティ・アウェアネスのプロセスはまれであり、試験対象の患者さんが生命を脅かす深刻な病状で、深刻な精神機能の欠落がみられる場合にのみ使用されます。これは、現場および医師のリーダーにとって重要なマイルストーンです。次のステップには、各地方の病院の施設審査委員会 (IRB) の承認と、ランダム化に取り組む医師のコミットメントが必要となります。
New YorkのMount Sinai Heart Health Systemの医学教授兼学務部長、RECOVER IV の試験責任医師であるGregg W. Stone医師は、次のように述べています。「この極めて重要なランダム化試験は、心原性ショック患者の登録にEFIC コミュニティの同意を得た最初の試験として歴史的なものです。心原性ショックのランダム化比較試験におけるインフォームド・コンセントの問題を解決するためのFDAの協力に感謝するとともに、医師のコミュニティにはRECOVER IV に患者を登録とランダム化を呼びかけていきます。」
急性心筋梗塞に伴う心原性ショック患者の治療における現在のベストプラクティスの詳細については、こちらをクリックしてください。
RECOVER IV RCT 試験の詳細については、こちらをクリックしてください。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP® SmartAssist®は、閉塞した冠動脈を再開通するためにステント留置術またはバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国FDAから承認されています。
Impella 2.5、Impella CP、Impella CP SmartAssist®、Impella 5.0®、Impella LD®、Impella 5.5® SmartAssist®は、心原性ショック状態にある心臓発作患者や心筋症患者を治療するための心臓ポンプとして米国FDAに承認されており、心臓の自然な回復を可能にする独自の機能を有しているため、患者さんが自分の心機能を回復させ帰宅することができます。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスと酸素化デバイスを提供するリーディングカンパニーです。当社製品は血行動態を改善し、呼吸不全の患者さんに十分な酸素を供給することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはhttps://www.abiomed.com/ をご覧ください。
将来見通しに関する記述
将来見通しに関する記述はいずれも、アビオメッドが米国証券取引委員会に提出した定期報告書で記載されたものなど、リスクと不確実性の影響を受けます。実際の結果は予想された結果とは大きく異なる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2022年9月16日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。