Impella RP Flex with SmartAssistが右心不全の治療としてFDA認可を取得
Impella RP Flex with SmartAssistが右心不全の治療としてFDA認可を取得
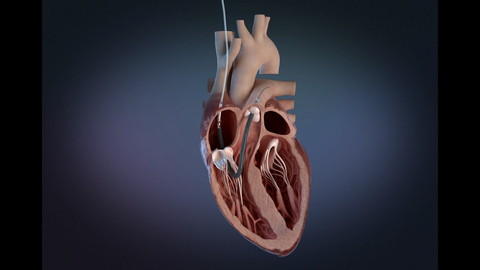
米マサチューセッツ州ダンバース--(BUSINESS WIRE)--(ビジネスワイヤ) -- (ビジネスワイヤ)-- アビオメッド(Nasdaq: ABMD)は、Impella RP Flex with SmartAssistが、最大14日間の急性右心不全治療に安全かつ有効であるとして、FDAの最高レベルの承認である米国食品医薬品局(FDA)市販前承認(PMA)を取得したことを発表します。Impella RP Flexは、患者さんが歩行可能な内頸静脈(IJ)より挿入され、管理を最適化するために設計されたデュアルセンサー技術を有しています。
Impella RPのプラットフォームは、患者さんの心臓本来の機能を回復するために設計された世界最小の経皮的右心循環補助装置(MCS)技術を搭載しています。体外循環を必要としない右心不全の治療として、FDAのPMAの適応を持つ唯一のMCS技術です。
Impella RP Flexの主な臨床的メリットは以下の通りです。
- 内頸静脈(IJ)経由の静脈シングルアクセスと11Frのカテーテルシャフトにより、患者さんの歩行が可能
- フレキシブルなカニュラとエキストラサポートガイドワイヤーの使用により、ポンプカテーテルの挿入ならびに留置が容易
- デュアルセンサーによるSmartAssistテクノロジーとImpella Connectにより、アドバンスメトリックスが使用可能でありポンプカテーテルの管理とウィニングを支援
- ヘパリンへの忍容性がない場合などヘパリンの使用が懸念される場合には、炭酸水素ナトリウムを添加し抗凝固管理を簡素化するヘパリンフリーパージを使用
HUMC/Hackensack Meridian Healthの心臓血管病院の心臓外科部長で心臓外科医のMark B. Anderson医師は次のように述べています。「Impella RP Flexは、患者の生存率の向上と心臓本来の機能回復を達成するためのアビオメッドの継続的取り組みを示しています。」
右心不全や右室機能障害を早期に発見し、Impella RPを早期に使用することは、生存率の有意な向上に関連します。Journal of Cardiac Failure誌およびJournal of American College of Cardiology誌に掲載された研究では、急性心筋梗塞に伴う心原性ショック(AMICS)患者の37%が右心機能障害を示し(Lalaら)、右心機能障害は死亡リスクが3倍に上昇することの関連が示されています(Mehtaら)。Journal of Heart and Lung Transplantationに発表されたデータによると、心原性ショック発症後48時間以内にImpella RPによるサポートを受けた患者の生存率は、それ以降に右心サポートを受けた患者よりも有意に高いことが示されました(73% vs 14%、p<0.001、Anderson et al.)
Kingwood Medical Centerのインターベンショナル循環器医であり心臓血管研究ディレクターのRobert Salazar医師は次のように述べています。「右室不全は複雑であるがゆえに、患者さんの病態は過小評価され、十分に治療されないことがあります。Impella RP Flexは、医師がこの困難な患者さんグループを治療するためのフレキシビリティを与える新しいツールです。」
Impella RP Flex with SmartAssistのFDAによる適応は以下の通りです。
体表面積1.5m2以上の患者で、左心補助循環装置によるサポート、心筋梗塞、心臓移植、開心術後に急性右心不全または心不全の症状が現れた場合に、最大14日間、一時的に右心室を補助することが適応とされています。
Impella RP Flexは、今四半期中に米国で限定的および段階的に使用が開始される予定です。日本においては承認申請準備中です。
Impella RP® SmartAssistについて
Impella RP® SmartAssistは、左心室補助装置の植込み、心筋梗塞、心臓移植、開心術後の右心不全または心不全の治療に使用することが米国FDAにより承認されています。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッド(ABMD)は、循環補助デバイスと酸素化デバイスを提供するリーディングカンパニーです。当社製品は血行動態を改善し、呼吸不全の患者さんに十分な酸素を供給することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはhttps://www.abiomed.com/ をご覧ください。
将来見通しに関する記述
将来見通しに関する記述はいずれも、アビオメッドが米国証券取引委員会に提出した定期報告書で記載されたものなど、リスクと不確実性の影響を受けます。実際の結果は予想された結果とは大きく異なる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2022年10月31日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
Media Contact:
Jenny Leary
Associate Director, U.S. Communications
+1 (978) 882-8491
jleary@abiomed.com
Investor Contact:
Todd Trapp
Executive Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com