L'FDA approva lo studio controllato randomizzato RECOVER IV con eccezione al consenso informato (EFIC)
L'FDA approva lo studio controllato randomizzato RECOVER IV con eccezione al consenso informato (EFIC)
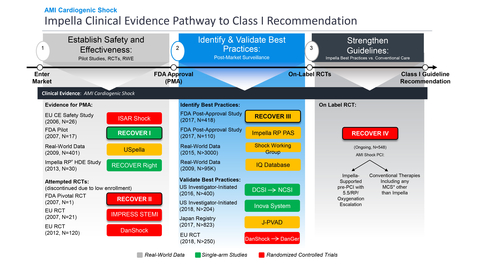
La FDA approva e chiude anche lo studio post-approvazione RECOVER III
DANVERS, Mass.--(BUSINESS WIRE)--Abiomed (Nasdaq: ABMD) annuncia due approvazioni da parte della Food and Drug Administration (FDA) statunitense relative alla ricerca clinica sulle pompe cardiache Impella in pazienti con infarto miocardico acuto (IMA) e shock cardiogeno.
L'FDA ha approvato lo studio randomizzato controllato (RCT) on-label RECOVER IV per i pazienti con shock cardiogeno da AMI. RECOVER IV è uno studio a due bracci che valuterà se l'intervento coronarico percutaneo (PCI), con supporto Impella iniziato prima del PCI, sia superiore al PCI senza supporto Impella.
"Questo studio di riferimento sarà il culmine di oltre 20 anni di ricerca sulla terapia interventistica dell'IMA e applicherà tutti i progressi clinici che abbiamo fatto per migliorare la sopravvivenza e il recupero del cuore dei pazienti affetti da IMA con shock cardiogeno, come dimostrato da molteplici studi prospettici", ha dichiarato William O'Neill, MD, direttore medico del Center for Structural Heart Disease presso l'Henry Ford Health e co-principale sperimentatore nazionale di RECOVER IV.
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l'unico giuridicamente valido.
Contacts
Contatto con i media:
Jenny Leary
Associate Director, U.S. Communications
+1 (978) 882-8491
jleary@abiomed.com
Contatto con gli investitori:
Todd Trapp
Executive Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com