Abiomed completa con successo tutti gli studi post-approvazione di Impella per la PCI ad alto rischio, lo shock cardiogeno, lo shock cardiogeno post-cardiotomia e l'insufficienza ventricolare destra
Abiomed completa con successo tutti gli studi post-approvazione di Impella per la PCI ad alto rischio, lo shock cardiogeno, lo shock cardiogeno post-cardiotomia e l'insufficienza ventricolare destra
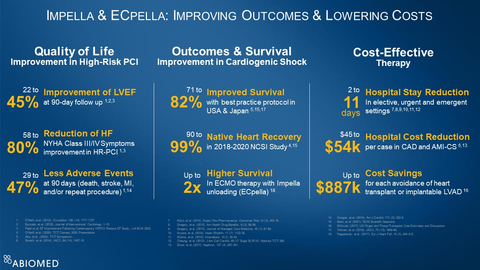
DANVERS, Mass.--(BUSINESS WIRE)--Abiomed (Nasdaq: ABMD) annuncia che la statunitense Food and Drug Administration (FDA) ha accettato e concluso i rapporti dello studio post-approvazione relativo alle approvazioni pre-marketing (PMA) per le pompe cardiache Impella. L'azione dell'FDA è un'ulteriore conferma che le pompe cardiache Impella sono sicure ed efficaci per lo shock cardiogeno, la PCI ad alto rischio, lo shock cardiogeno post-cardiotomia, lo shock cardiogeno nella miocardite o nella cardiomiopatia, e per l'insufficienza ventricolare destra.
L'FDA solitamente richiede studi post-approvazione per dispositivi medicali che ricevono una PMA, la. massima approvazione normativa rilasciata dall'FDA.
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l'unico giuridicamente valido.
Contacts
Per maggiori informazioni:
Media:
Jenny Leary
Direttore associato, Comunicazioni USA
+1 (978) 882-8491
jleary@abiomed.com
Investitori:
Todd Trapp
Vicepresidente Esecutivo e Direttore finanziario
+1 (978) 646-1680
ttrapp@abiomed.com