アビオメッドのpreCARDIAシステム使用の有用性がアーリー・フィージビリティ・スタディにより実証
アビオメッドのpreCARDIAシステム使用の有用性がアーリー・フィージビリティ・スタディにより実証
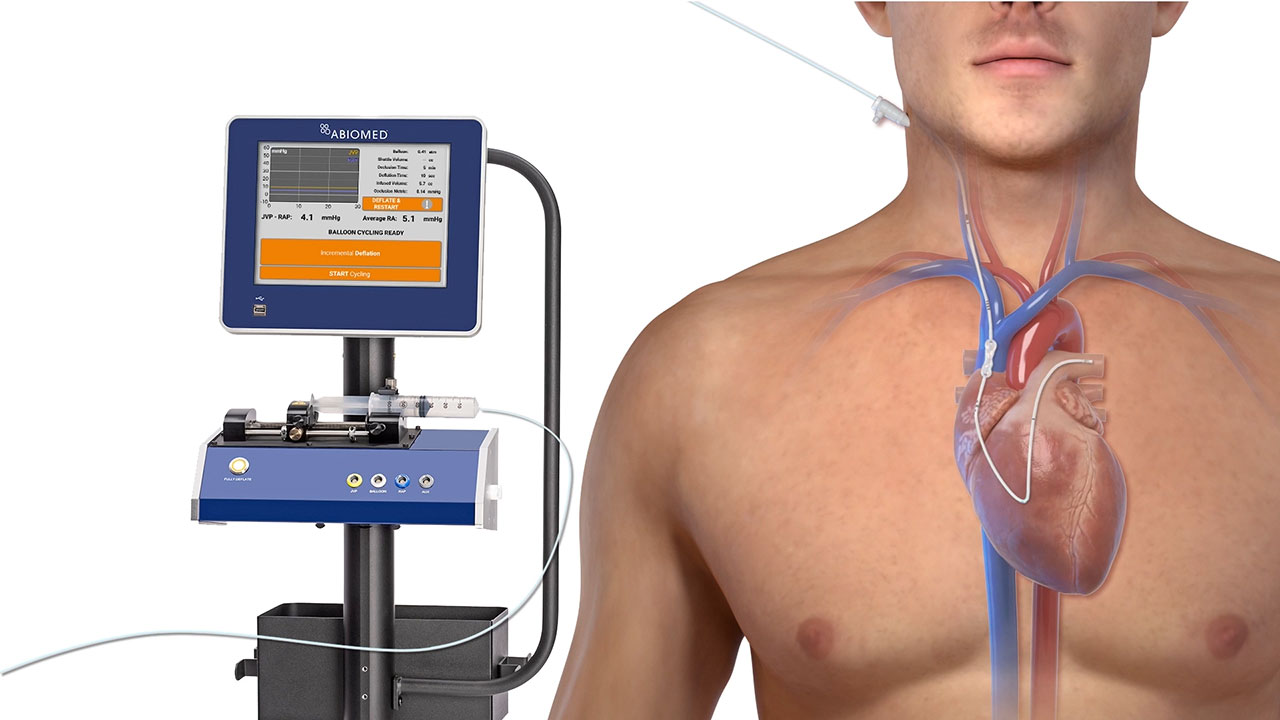
米マサチューセッツ州ダンバース--(BUSINESS WIRE)--(ビジネスワイヤ) -- (ビジネスワイヤ) -- アビオメッド(NASDAQ: ABMD)は、preCARDIAシステムを患者さんに使用した初めてのアーリー・フィージビリティ・スタディについて、その有用性を示す結果を発表しました。preCARDIAシステムは、上大静脈を間欠的に閉塞することで、急性非代償性心不全(ADHF)患者のうっ血症状を改善するよう設計されています。本試験の結果は先日、Circulation: Heart Failure誌に掲載されました。
薬剤治療にも関わらず、心不全は65歳以上の高齢者の入院の主な原因となっています。利尿剤は、過剰な体液貯留を低減することで、心不全の症状や心機能の改善に役立つ可能性があります。しかし、利尿剤による効果が明らかになるには時間を要し、また、慢性心不全患者さんには効果が不十分な場合があります。preCARDIAは、患者さんの心臓や肺に入る過剰な血液充満圧を下げるよう設計されています。血液充満圧が下がることになり心臓や腎臓がより効率的に機能することで、利尿剤に反応しない患者さんを治療できるポテンシャルを持っています。米国では、対象となり得る患者さんは年間100万人の急性非代償性心不全入院患者のうち約30万人と推定されます。
多施設共同前向き単群試験のVENUS-HFアーリー・フィージビリティ・スタディでは、急性非代償性心不全患者30人を12時間または24時間のpreCARDIA療法に割り当てて効果を検討しました。主要評価項目は、30日後までの主要有害事象の複合発生率としました。本試験では、下記に示す結果が確認されました。
- デバイスや手術に関連した主要有害事象の発生は全ての患者で認められなかった(n=0/30、0%)
- 患者の97%(n=29/30)がpreCARDIAの留置、起動、離脱に成功
- 右心房圧はベースラインより34%低下(p<0.001)
- 肺毛細血管楔入圧はベースラインより27%低下(p<0.001)
- 尿量は治療前より130%増加(p<0.01)
- 貯留体液の純排出量は治療前より156%増加 (p<0.01)
本試験の筆頭著者でタフツ医療センター・心血管研究イノベーションセンターのエグゼクティブ・ディレクターであるNavin Kapur医師は、次のように述べています。「本試験は、安全性と実現可能性の評価項目を達成し、preCARDIAシステムが、急性非代償性心不全患者において上大静脈を間欠的に閉塞することで心充満圧を迅速に低下させ、尿量を増加できることを初めて示しました。」
この結果は、preCARDIAの追加の試験実施を可能にするもので、2020年11月に米国食品医薬品局(FDA)は、preCARDIAのアーリー・フィージビリティ・スタディについて、30人の患者を追加し、計60人の患者に拡大することを承認しています。
preCARDIAは治験用デバイスであり、米国連邦法により用途は治験での使用に限定されています。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスと酸素化デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、呼吸不全の患者さんに十分な酸素を供給することで心筋の負担を軽減し、その回復を目指しています。詳細情報については https://www.abiomed.com/をご覧ください。
将来見通しに関する記述
将来見通しに関する記述はいずれも、アビオメッドが米国証券取引委員会に提出した定期報告書で記載されたものなど、リスクと不確実性の影響を受けます。実際の結果は予想された結果とは大きく異なる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2022年1月12日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
Media:
Tom Langford
Director of Communications
+1 (978) 882-8408
tlangford@abiomed.com
Investors:
Todd Trapp
Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com