2件の大規模試験が、Impella心臓ポンプによる完全な血行再建が駆出率と長期患者転帰を改善することを実証
2件の大規模試験が、Impella心臓ポンプによる完全な血行再建が駆出率と長期患者転帰を改善することを実証
米フロリダ州オーランド--(BUSINESS WIRE)--(ビジネスワイヤ) -- (ビジネスワイヤ)-- 前向き試験のPROTECT IIIおよびRestore EFの最終結果が報告され、Impella心臓ポンプ使用がハイリスクPCI患者の治療成績を改善することが示しました。これらの試験結果は11月4日朝、Cardiovascular Research Foundationの年次科学シンポジウムである Transcatheter Cardiovascular Therapeutics(TCT)2021で、ニューヨーク市のマウントサイナイ・ヘルスシステムのアカデミックアフェアー・ディレクターを務めるGregg Stone医師より報告されました。発表はhttps://www.heartrecovery.com/tct-2021よりオンデマンドで視聴いただけます。
Gregg Stone医師は次のように述べています。「これら2本の前向き試験から得られた最新データより、Impellaを使用したハイリスクPCI治療が、患者の安全性を向上させMACCEを低減させるベストプラクティスであることを証明しています。これらのベストプラクティスは、ハイリスクPCIでImpellaを使用する試験として進行中のPROTECT IVランダム化対照試験の一部として、より広範な患者集団を対象に検討が行われています。この試験では、ImpellaによってハイリスクPCI治療中に血行動態を安定させることで、ステント植え込みの一層の最適化と完全な血行再建を促進し、結果的に早期および後期の患者転帰が改善される、という仮説を立てています。」
PROTECT IIIの最終結果
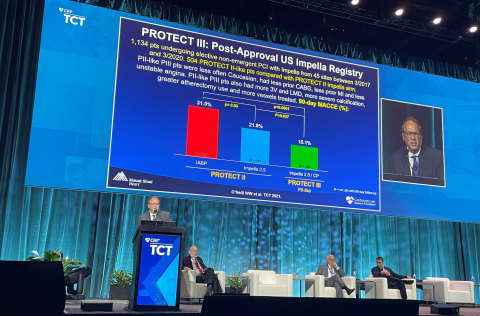
PROTECT III前向き試験は、PROTECT IIランダム化対照試験(RCT)との比較で、90日後の臨床転帰改善、血行再建の完全性、安全性を示しました。PROTECT II RCTは、大動脈内バルーンパンピング(IABP)との比較で、Impellaの使用が90日後にMACCE発現の相対リスクを29%低減させることを示しました。
研究者らは、PROTECT III試験に参加した患者の中で、PROTECT IIの組み入れ基準に適合しうる患者、すなわち「PII同等」患者を分析し、それらをPROTECT IIの患者と比較しました。PROTECT III の患者は、PROTECT IIの患者と比較して、90日後のMACCE発現率が改善していました(15.1%対21.9%、p=0.037)。これは31%の相対リスク低下となります(図1参照)。
また、研究者らはPROTECT IIIの患者が、PROTECT IIの患者と比較して、下記の特徴を持つことを指摘しています。
- 病変がより複雑で、石灰化がより重症化しており、回転式アテレクトミーの実施例が多く、治療を受けた血管の本数が多かった。
- 血行再建がより完全なものとなり、補助中の低血圧は78%少なかった(2.2%対10.2%、p=0.0004)。
- 入院中の安全性が改善され、輸血を必要とする出血性合併症が有意に少なかった(1.2%対9.4%、p<0.001)。
Restore EFの最終結果
Restore EF前向き試験は、ハイリスクPCIでImpellaを使用した最新のベストプラクティスの採用により、地方、都市部、コミュニティー、大学のセンターを含むさまざまな病院で、90日間のフォローアップで左室駆出率(LVEF)、心不全症状、狭心症症状が有意に改善することを示しました。
26病院の患者251人を対象とした試験から、下記の結果が示されました。
- ベースライン時から90日間のフォローアップでLVEFが有意に改善(35%から45%、p<0.0001)。90日後のLVEF改善は本試験の主要評価項目です。Impella補助下のハイリスクPCIにおけるLVEFの改善を証明する証拠が増え続けており、Restore EFはその試験として最新のものとなります(図2参照)。
- 心不全症状が有意に低減し、New York Heart Association(NYHA)分類III/IV度がフォローアップ時点で76%低減しました(62%から15%、p<0.001)(図3参照)。
- 狭心症症状が有意に低減し、Canadian Cardiovascular Society(CCS)分類III/IV度がフォローアップ時点で97%低減しました(72%から2%、p<0.0001)(図3参照)。
技術の進歩とベストプラクティス
PROTECT II以降、Impella補助下のハイリスクPCIは進化し、より効果的なImpella CP SmartAssist心臓ポンプが加わり、この心臓ポンプはRestore EF試験およびPROTECT III試験において約3分の2の患者で使用されました。
PROTECT III試験の治験責任医師であるJeff Moses医師(コロンビア大学メディカルセンター:ニューヨーク市、心血管インターベンション治療科長兼内科教授、セントフランシス病院&ハートセンター:ニューヨーク州ロズリンの先進的心臓インターベンション科長)は、次のように述べています。「技術の進歩は、ベストプラクティスの習得や使用者の経験と相まって、近年の治療において患者転帰の改善をもたらしました。これら2件の試験は、先行する試験を拡大したものであり、現在のより広範な患者集団に対する臨床的利点を示しています。」
PROTECTシリーズの各試験とRestore EF試験は、臨床転帰を改善するという当社の取り組みの一環として、アビオメッド(NASDAQ: ABMD)によって研究支援されています。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術やバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国FDAの承認を取得しています。
Impella 2.5、Impella CP、Impella CP SmartAssist®、Impella 5.0®、Impella LD®、Impella 5.5® SmartAssist®は、心原性ショック状態にある心臓発作または心筋症患者の治療を目的に米国FDAの承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスと酸素化デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、呼吸不全の患者さんに十分な酸素を供給することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはhttps://protect-us.mimecast.com/s/yKUICL9nPQHwKRg5HA1MGP?domain=abiomed.comをご覧ください。
将来見通しに関する記述
将来見通しに関する記述はいずれも、アビオメッドが米国証券取引委員会に提出した定期報告書で記載されたものなど、リスクと不確実性の影響を受けます。実際の結果は予想された結果とは大きく異なる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2021年11月4日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
For further information:
Media Contact:
Tom Langford
Director of Communications
+1 (978) 882-8408
tlangford@abiomed.com
Investor:
Todd Trapp
Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com