Deux études d'envergure démontrent que la revascularisation complète à l'aide des pompes cardiaques Impella améliore la fraction d'éjection et les résultats des patients sur le long terme
Deux études d'envergure démontrent que la revascularisation complète à l'aide des pompes cardiaques Impella améliore la fraction d'éjection et les résultats des patients sur le long terme
ORLANDO, Floride--(BUSINESS WIRE)--Les résultats définitifs des études prospectives PROTECT III et Restore EF démontrent des résultats améliorés pour les patients ICP à risque élevé grâce à l'utilisation des pompes cardiaques Impella . Les résultats de ces études ont été analysés ce matin lors du Transcatheter Cardiovascular Therapeutics (TCT) 2021, le symposium scientifique annuel de la Cardiovascular Research Foundation, par Gregg Stone, DM, directeur des Affaires universitaires au Mount Sinai Health System de New York. La présentation est disponible en visionnage à la demande sur www.heartrecovery.com/tct-2021.
« Les données actuelles provenant de ces deux études prospectives offrent des éléments de preuves confirmant que l'adoption des meilleures pratiques Impella permet d'améliorer la sécurité et de réduire le taux de MACCE dans la population de patients ICP à risque élevé », a déclaré le Dr. Stone. « Ces meilleures pratiques sont étudiées dans une population de patients plus vaste, dans le cadre de l'essai en cours randomisé contrôlé PROTECT IV portant sur l'utilisation d'Impella chez des patients ICP à risque élevé. Il est donc possible d'émettre l'hypothèse qu'en assurant une stabilité hémodynamique lors de l'intervention coronarienne percutanée (ICP) à risque élevé, la pompe Impella facilitera une implantation du stent plus optimale et une revascularisation complète, qui se traduiront en une amélioration des résultats patients précoces et tardifs ».
Résultats définitifs de l'étude PROTECT III
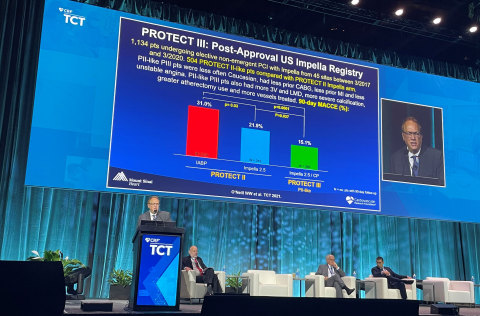
L'étude prospective PROTECT III démontre une amélioration des résultats cliniques à 90 jours, l'achèvement de la revascularisation, et la sécurité, en comparaison avec l'essai randomisé contrôlé PROTECT II (RCT). L'essai randomisé contrôlé PROTECT II RCT a permis de constater que l'utilisation de la pompe Impella aboutissait à 29 % de réduction du risque relatif de MACCE à 90 jours, en comparaison avec une pompe à ballonnet intra aortique (PBIA).
Les auteurs de cette étude ont analysé les patients de l'essai PROTECT III susceptibles d'être éligibles pour l'essai PROTECT II - "patients PII" - qu'ils ont comparés aux patients de l'essai PROTECT II. Les patients PROTECT III avaient amélioré leurs taux de MACCE à 90 jours, en comparaison avec les patients PROTECT II (15,1 % contre 21,9 %, p=0,037). Ceci représente une réduction du risque relatif de 31 %. (voir schéma 1)
Les auteurs de l'étude font également remarquer que les patients de l'essai PROTECT III, en comparaison avec les patients de l'essai PROTECT II :
- étaient plus complexes, avec une calcification et une athérectomie rotative plus intenses et un plus grand nombre de vaisseaux traités.
- présentaient une revascularisation plus complète, avec 78% de réduction de l'hypotension avec le support de la pompe (2,2% contre 10,2%, p=0,0004).
- démontraient une amélioration de la sécurité hospitalière, avec un nombre sensiblement inférieur de complications hémorragiques nécessitant une transfusion (1,2 % contre 9,4 %, p<0,001).
Résultats définitifs de l'essai Restore EF
L'étude prospective Restore démontre l'utilisation des meilleures pratiques actuelles avec la pompe Impella chez des patients ICP à risque élevé permet d'améliorer sensiblement la fraction d'éjection ventriculaire gauche (FEVG), les symptômes d'insuffisance cardiaque, ainsi que les symptômes angineux lors d'un suivi à 90 jours dans tout un éventail d'environnements hospitaliers, notamment les centres ruraux, urbains, communautaires et universitaires.
L'analyse de 251 patients dans 26 hôpitaux a montré :
- une amélioration significative de la fraction d'éjection ventriculaire gauche (FEVG) à partir de la valeur de départ jusqu'au suivi à 90 jours (35 % - 45 % p<0,0001). L'amélioration de la FEVG à 90 jours constitue le critère d'évaluation principal de l'étude. Restore EF est la toute dernière étude, étayée par un ensemble toujours croissant de preuves, qui démontre une amélioration de la FEVG avec l'utilisation de la pompe Impella (voir schéma 2)
- Une réduction significative des symptômes d'insuffisance cardiaque : 76 % selon la classification III/IV réalisée par la New York Heart Association (NYHA) lors du suivi (62 % - 15 % p<0,001). (voir schéma 3)
- Une réduction significative des symptômes angineux : 97 % selon la classification III/IV réalisée par la Canadian Cardiovascular Society (CCS) lors du suivi (72 % - 2 % p<0,0001). (voir schéma 3)
Avancées en matière de technologies et de meilleures pratiques
Depuis l'essai PROTECT II, l'ICP à risque élevé pris en charge par une pompe Impella a évolué jusqu'à inclure la pompe cardiaque la plus puissante Impella CP avec SmartAssist, utilisée chez environ deux-tiers des patients des études Restore EF et PROTECT III.
« Les avancées technologiques, ainsi que les apprentissages des meilleures pratiques et l'expérience des opérateurs, ont conduit à des améliorations en termes de résultats patients dans la pratique actuelle », a affirmé Jeff Moses, DM, principal investigateur de l'étude PROTECT III, directeur des Traitements cardiovasculaires interventionnels et professeur de médecine à la Columbia University Medical Center de New York, et directeur des interventions cardiaques avancées au St. Francis Hospital and Heart Center de Roslyn, dans l'Etat de New York. « Ces deux études ont permis d'élargir la recherche et démontrent un bénéfice clinique dans la plus large population de patients d'aujourd'hui », a-t-il ajouté.
La série d'études PROTECT et l'étude Restore EF sont sponsorisées par Abiomed (NASDAQ : ABMD) dans le cadre de son engagement à améliorer les résultats cliniques.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Les dispositifs Impella 2.5® et Impella CP® bénéficient d'une approbation avant commercialisation de la FDA américaine pour le traitement de certains patients atteints d'insuffisance cardiaque avancée qui subissent des interventions coronaires percutanées (ICP) électives et urgentes, telles l’angioplastie par pose de stent ou de ballonnet, afin de rouvrir les artères coronaires obstruées.
Les dispositifs Impella 2.5, Impella CP, Impella CP avec SmartAssist®, Impella 5.0®, Impella LD® et Impella 5.5™ avec Smart Assist® sont des pompes cardiaques approuvées par la FDA américaine utilisées pour traiter les patients subissant des crises cardiaques ou atteints de cardiomyopathie en état de choc cardiogénique. Elles ont la capacité unique de permettre la récupération de la fonction cardiaque native, permettant ainsi aux patients de rentrer chez eux sans être greffés.
À PROPOS D'ABIOMED
Basé à Danvers, dans le Massachusetts, aux États-Unis, Abiomed, Inc. est un fournisseur de premier plan de dispositifs médicaux offrant assistance circulatoire et oxygénation. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant le flux sanguin et/ou d'apporter une oxygénation suffisante aux personnes souffrant d'insuffisance respiratoire. Pour en savoir plus, veuillez visiter le site www.abiomed.com.
DÉCLARATIONS PROSPECTIVES
Toute déclaration prospective est assujettie à des risques et à des incertitudes tels qu'ils sont décrits dans les rapports périodiques d'Abiomed, déposés auprès de la Securities and Exchange Commission. Les résultats réels pourraient différer sensiblement des résultats prévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Pour de plus amples informations :
Contact médias :
Tom Langford
Directeur de la communication
+1 (978) 882-8408
tlangford@abiomed.com
Investisseur :
Todd Trapp
Vice-président et directeur financier
+1 (978) 646-1680
ttrapp@abiomed.com