RevBio erhält Genehmigung der britischen Arzneimittelbehörde zur Einleitung einer klinischen Studie mit einer optimierten Formulierung seines knochenklebenden Biomaterials für die Zahnmedizin
RevBio erhält Genehmigung der britischen Arzneimittelbehörde zur Einleitung einer klinischen Studie mit einer optimierten Formulierung seines knochenklebenden Biomaterials für die Zahnmedizin
RevBio erhält Genehmigung, mit einer klinischen Studie in Großbritannien zu beginnen, die eine modifizierte Formulierung seines knochenklebenden Biomaterials für die Zahnimplantologie prüft.
LOWELL, Mass.--(BUSINESS WIRE)--RevBio, Inc., meldet, dass das Unternehmen die Genehmigung der britischen Arzneimittelbehörde MHRA (Medicines and Healthcare Products Regulatory Agency) zur Einleitung einer klinischen Studie an 15 Patienten erhalten hat, im Rahmen derer die Sicherheit und Wirksamkeit einer optimierten Formulierung von Tetranite®, dem knochenklebenden Biomaterial des Unternehmens, bei der sofortigen Stabilisierung von Zahnimplantaten nach Zahnextraktion geprüft wird.
Dr. Michael R. Norton, BDS, FDS, RCS(Ed), ein Londoner Kieferchirurg, bekannter Dozent und ehemaliger President der Academy of Osseointegration, ist Hauptprüfer der klinischen Studie. „Ich freue mich sehr, an dieser klinischen Studie mitzuwirken, die auf der von mir Anfang des Jahres abgeschlossenen ersten Studie aufbaut“, so Dr. Norton. „Seit der Einleitung der vorherigen MHRA-genehmigten Studie in Großbritannien hat RevBio das knochenfördernde Potential seines Biomaterials erheblich verbessert.”
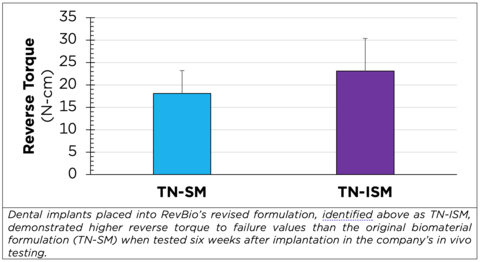
RevBio hat das knochenklebende Biomaterial in erster Linie durch Anpassung des pH-Werts optimiert, den das Material während der Selbsterhärtungsreaktion aufweist. Außerdem hat das Unternehmen auch die Porosität des Materials erhöht. Labor- und Tierversuche haben gezeigt, dass diese Abwandlungen die Biokompatibilität des Materials mit dem die Stelle der Zahnextraktion umgebenen Zahnfleisch verbessert. Diese Veränderungen der Formulierung haben auch die Ersatzrate der neuen Knochenbildung gesteigert, ohne die Fähigkeit des Materials, am Knochen anzuhaften, zu opfern. Es verhält sich sogar so, dass diese Formulierung noch stärker anhaftet, als die vorherige zahnmedizinische Formulierung des Unternehmens.
Analog zur vorherigen Studie von Dr. Norton konzentriert sich die neue klinische Studie speziell auf die vorderen Zähne in der kosmetisch bedeutsamen Zone des „Lächelns”, in der ein Zahnverlust besonders auffällt. Dabei erhalten die Patienten beim Einbringen der Implantate vorläufige Kronen, sodass bei vielen Patienten ein kostspieliger, komplexer und langwieriger Knochenaufbau nicht mehr erforderlich ist, was als Verkürzung der Gesamtdauer der Behandlung zu Buche schlägt.
„Wir freuen uns über die erneute Zusammenarbeit mit Dr. Norton, der ein Vordenker bei der Weiterentwicklung der klinischen Praxis auf dem Gebiet der dentalen Implantologie ist“, so Alan Pollack, Senior Director of Dental Clinical Operations bei RevBio. „Die Entwicklung dieser neuen Formulierung hat die Fähigkeit des Unternehmens, die Leistungsmerkmale des Biomaterials auf die Erfordernisse spezieller anatomischer Situation abzustimmen, wirklich vorangebracht.”
Über RevBio, Inc.
RevBio, Inc., ist ein mit der klinischen Phase der Entwicklung befasstes Medizinprodukte-Unternehmen, das sich mit der Entwicklung und Vermarktung eines patentierten, synthetischen, injizierbaren, selbsthärtenden und osteokonduktiven, knochenklebenden Biomaterials namens Tetranite® befasst. Das Unternehmen entwickelt diese Technologie zunächst für die Bereiche Zahnmedizin, kraniale und allgemeine Orthopädie sowie Veterinärmedizin. Die Tetranite-Technologie von RevBio ist noch nicht für den Handel zugelassen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Contacts
Michael Tiedemann
6177630923
mtiedemann@revbio.com