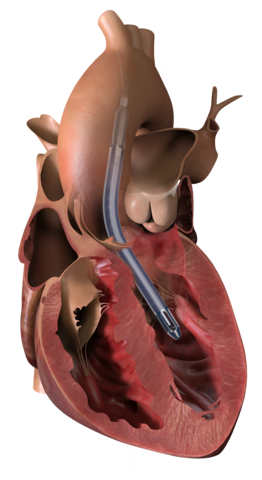
Approvata a livello normativo Impella 5.5 con SmartAssist in Giappone e a Hong Kong; la FDA statunitense concede a Impella BTR l'approvazione condizionale IDE per il primo studio di fattibilità precoce su soggetti umani
Approvata a livello normativo Impella 5.5 con SmartAssist in Giappone e a Hong Kong; la FDA statunitense concede a Impella BTR l'approvazione condizionale IDE per il primo studio di fattibilità precoce su soggetti umani
DANVERS, Massachusetts--(BUSINESS WIRE)--Gli enti normativi di tre paesi hanno autorizzato vari prodotti chirurgici Impella, mentre Abiomed (NASDAQ: ABMD) continua ad eseguire la propria strategia per una crescita sostenibile con nuovi prodotti, nuove indicazioni e nuove geografie. Negli Stati Uniti, la Food and Drug Administration (FDA) ha approvato una domanda di esenzione per un dispositivo sperimentale (Investigational Device Exemption, IDE) soggetto a uno studio di fattibilità precoce (EFS, Early Feasibility Study) di Impella BTR (Bridge-to-Recovery). In Asia, Impella 5.5 con SmartAssist ha ricevuto l'approvazione dall'Agenzia per i prodotti farmaceutici e medicali (PMDA, Pharmaceuticals and Medical Devices Agency) in Giappone e dalla Divisione per i dispositivi medicali (MDD, Medical Device Division) a Hong Kong.
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l'unico giuridicamente valido.
Contacts
Per maggiori informazioni contattare:
Contatto per i media
Tom Langford
Direttore comunicazioni
+1 (978) 882-8408
tlangford@abiomed.com
Contatto per gli investitori
Todd Trapp
Vice Presidente e Direttore finanziario
+1 (978) 646-1680
ttrapp@abiomed.com