Größte Studie zu hämodynamisch unterstützten Hochrisiko-PCI-Patienten zeigt: Vollständigere Revaskularisierung mit Impella führt zu besseren Ergebnissen
Größte Studie zu hämodynamisch unterstützten Hochrisiko-PCI-Patienten zeigt: Vollständigere Revaskularisierung mit Impella führt zu besseren Ergebnissen
DANVERS, Massachusetts--(BUSINESS WIRE)--Abiomed (NASDAQ: ABMD) meldet neue Daten aus der Studie PROTECT III. Diese zeigen geringere MACCE-Raten (MACCE = Major Adverse Cerebrovascular and Cardiovascular Event), d. h. Schlaganfall, Tod, Myokardinfarkt und Wiederholungsbehandlungen, wenn Impella eingesetzt wird, um eine vollständigere Revaskularisierung in einem einzigen Setting für Hochrisikopatienten mit perkutaner koronarer Intervention (Percutaneous Coronary Intervention, PCI) zu erreichen. PROTECT III ist eine laufende, prospektive, einarmige FDA-Nachzulassungsstudie für die PMA-Zulassung von Impella 2.5 und Impella CP bei Hochrisiko-PCI. Die Ergebnisse der PROTECT-III-Zwischenanalyse werden heute um 15.24 Uhr EDT von William O'Neill, MD, dem Medical Director des Center for Structural Heart Disease am Henry Ford Hospital, auf der TCT Connect, dem 32. jährlichen wissenschaftlichen Symposium der Cardiovascular Research Foundation, im Rahmen der „Best of Abstracts“-Session vorgestellt.
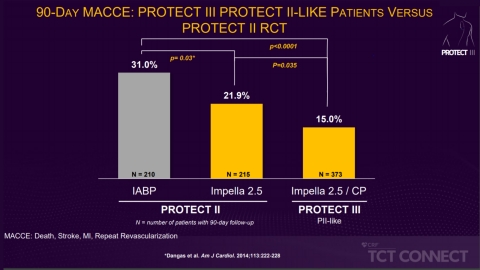
PROTECT III baut auf der randomisierten kontrollierten Studie PROTECT II auf, in der festgestellt wurde, dass die Anwendung von Impella im Vergleich zu einer intraaortalen Ballonpumpe (IABP) nach 90 Tagen zu einer MACCE-Reduktion um 29% führte. Die Autoren der Studie analysierten Patienten in PROTECT III, die sich für PROTECT II qualifiziert hätten, so genannte "PII-ähnliche" Patienten, und verglichen sie mit PROTECT-II-Patienten. PII-ähnliche Patienten in PROTECT III hatten im Vergleich zu PROTECT-II-Patienten verbesserte 90-Tage-MACCE-Raten (15% gegenüber 21,9%; p=0,035). (Siehe Abbildung 1)
In der Studie wurde auch festgestellt, dass PII-ähnliche Patienten in PROTECT III älter, kränker und komplexer waren, mehr Komorbiditäten aufwiesen, dass mehr Gefäße behandelt und mehr Rotationsatherektomien durchgeführt wurden, dass aber dennoch ihre Sicherheit im Krankenhaus verbessert worden war:
- Signifikant weniger Blutungskomplikationen (1,8% gegenüber 12,5%; p<0,001)
- Ähnlich niedrige vaskuläre Komplikationen (1,0% gegenüber 1,4%; p=0,659)
- Ähnlich niedrige Schlaganfallzahlen (0,40% gegenüber 0,46%; p=0,913)
Die PROTECT-Serie von klinischen FDA-Studien, zu denen PROTECT I, die randomisierte, kontrollierte Studie PROTECT II sowie PROTECT III gehören, ist die bisher größte FDA-Studie an hämodynamisch unterstützten PCI-Hochrisikopatienten. Diese PROTECT-III-Zwischenanalyse umfasste 1.143 Patienten, die sich zwischen März 2017 und September 2019 an 45 Standorten einer elektiven, nicht dringenden PCI mit Impella unterzogen hatten.
„Diese Daten stellen eine wichtige Fortsetzung unserer Kenntnisse über die Hochrisiko-PCI dar. Wenn wir auf die PROTECT-II-Daten zurückblicken, haben wir die Sicherheit und Wirksamkeit von Impella erkannt”, so Jeffrey W. Moses, MD, ein Studienleiter von PROTECT III und Director of Interventional Cardiovascular Therapeutics sowie Medizinprofessor am Columbia University Medical Center. „Jetzt aber, nachdem bei PROTECT III weniger unerwünschte Ereignisse aufgetreten sind, wissen wir, wie wir „Best Practices“ anwenden und bessere Ergebnisse für die Patienten erzielen können.”
„Diese neuartigen, aktuellen Daten aus PROTECT III zeigen deutlich, wie die Entwicklung und Umsetzung von Impella-Best-Practices die Sicherheit und die MACCE-Rate verbessern kann, und sie liefern wichtige Informationen für die Vorbereitung der bevorstehenden randomisierten kontrollierten Studie PROTECT IV zu Impella bei Hochrisiko-PCI”, so Dr. O’Neill.
PROTECT III ist Teil einer wachsenden Zahl von Nachweisen, die den Nutzen einer vollständigeren Revaskularisierung bei der Hochrisiko-PCI belegen, was wiederum zu besseren Patientenergebnissen führt. Die Restore EF-Studie, die gestern auf der TCT Connect vorgestellt wurde, zeigt, dass der Einsatz von Impella bei der Hochrisiko-PCI durch die Anwendung zeitgemäßer Best Practices eine signifikante Verbesserung der linksventrikulären Ejektionsfraktion (LVEF), der Herzinsuffizienz-Symptome und der pektanginösen Beschwerden bei Nachuntersuchung nach Tagen in einer Vielzahl von Krankenhäusern, darunter ländliche, städtische, kommunale und akademische Zentren, bewirkt. PROTECT III stärkt zudem die gesamte Evidenzlage zur Sicherheit von Impella, was in Abbildung 2 im Detail dargestellt ist.
Die Nachzulassungsstudie PROTECT III wird über Best-Practice-Protokolle für die bevorstehende zweiarmige PROTECT-IV-RCT Aufschluss geben, in der die wichtigsten Erkenntnisse aus der cVAD-Studie, der Impella-Quality-Datenbank (IQ-Datenbank) und die seit Abschluss der PROTECT-II-RCT gesammelten Daten aus der Praxis genutzt und validiert werden. In PROTECT IV wird die vollständige Revaskularisierungs-PCI mit Impella mit einer vollständigen Revaskularisierungs-PCI ohne geplante hämodynamische Unterstützung verglichen.
Die PROTECT-Studienreihe wird von Abiomed als Teil des Engagements des Unternehmens zur Verbesserung der klinischen Ergebnisse finanziell unterstützt.
Zum Austausch von bewährten Verfahren (Best Practices) bei risikoreichen PCI veranstaltet Abiomed am Samstag, dem 17. Oktober, um 14.00 Uhr EDT auf TCT Connect ein Symposium mit dem Titel Protected PCI in COVID-19 Era: The Rise in Importance of Complete Revascularization. Das Symposium wird geleitet von Dr. Cindy Grines, Chief Scientific Officer des Northside Hospital Cardiovascular Institute in Atlanta und Präsidentin der Society for Cardiovascular Angiography and Interventions (SCAI). Darin werden bewährte Verfahren für den Einsatz der perkutanen mechanischen Kreislaufunterstützung vorgestellt, um eine vollständige Revaskularisierung bei Hochrisikopatienten zu ermöglichen.
ÜBER IMPELLA-HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung der US-amerikanischen Arzneimittelbehörde FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen erhalten, die sich einer elektiven und dringlichen perkutanen Koronarintervention (PCI), wie etwa einer Stentimplantation oder Ballonangioplastie, unterziehen, um verstopfte Koronararterien freizumachen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit Smart Assist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Die Impella RP® ist von der FDA zur Behandlung von Rechtsherzinsuffizienz oder -dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, einem Myokardinfarkt, einer Herztransplantation oder einer Operation am offenen Herzen zugelassen. Das Impella-RP-System darf außerdem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden rechtsventrikulären Unterstützung für die Dauer von bis zu 14 Tagen bei Intensivpatienten mit einer Körperoberfläche von ≥ 1,5 m2 zur Behandlung einer akuten Rechtsherzinsuffizienz oder Dekompensation aufgrund von Komplikationen im Zusammenhang mit der Coronavirus-Erkrankung 2019 (COVID-19), einschließlich Lungenembolie (PE), eingesetzt werden. Das Impella-RP-System ist nicht für die Behandlung einer akuten Rechtsherzinsuffizienz oder Dekompensation aufgrund von Komplikationen im Zusammenhang mit COVID-19 freigegeben oder zugelassen. Die Unterstützungssysteme von Impella für die linke Herzkammer (LV) dürfen zudem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden (≤ 4 Tage für Impella 2.5, Impella CP und Impella CP mit SmartAssist; und ≤ 14 Tage für Impella 5.0 und Impella 5.5 mit SmartAssist) LV-Entlastung und Unterstützung der Behandlung von Intensivpatienten mit bestätigter COVID-19-Infektion, die sich einer ECMO-Behandlung unterziehen und ein Lungenödem bei Unterstützung durch V-A-ECMO oder eine späte kardiale Dekompensation durch Myokarditis bei Unterstützung durch V-V ECMO entwickeln, eingesetzt werden. Die genehmigten Impella-LV-Unterstützungssysteme sind für einen Einsatz im Zusammenhang mit der genehmigten Indikation weder freigegeben noch zugelassen. Die Impella RP- und Impella LV-Unterstützungssysteme wurden von der FDA im Rahmen einer EUA für die oben genannte Notfallverwendung genehmigt und lediglich für die Dauer der Erklärung, dass Umstände vorliegen, die die Genehmigung der Notfallverwendung von Medizinprodukten nach Abschnitt 564(b)(1) des Gesetzes, 21 U.S.C. § 360bbb-3(b)(1) rechtfertigen, es sei denn, die Genehmigung wird früher aufgehoben oder widerrufen.
In Europa besitzen Impella 2.5, Impella CP und Impella CP mit SmartAssist die CE-Kennzeichnung für die Behandlung von Hochrisiko-PCI- und AMI-Patienten mit kardiogenem Schock für bis zu 5 Tage. Impella 5.0 und Impella LD besitzen die CE-Kennzeichnung für die Behandlung von Patienten mit Herzinfarkt oder Kardiomyopathie im kardiogenen Schock für bis zu 10 Tage. Impella 5.5 mit SmartAssist ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten im kardiogenen Schock bis zu 30 Tage lang zu behandeln. Impella RP ist CE-gekennzeichnet zur Behandlung von Rechtsherzinsuffizienz oder Dekompensation nach Implantation eines Linksherzunterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie. Weitere Informationen über die Impella-Plattform von Herzpumpen, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen im Zusammenhang mit der Verwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Informationen finden Sie unter www.abiomed.com. Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA und bestimmten anderen Ländern eingetragen. Impella BTR, Impella ECP, CVAD Study und STEMI DTU Study sind angemeldete Marken von Abiomed, Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter auch in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, das kommerzielle Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende regulatorische Genehmigungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unwägbarkeiten im Zusammenhang mit Umfang, Ausmaß und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Genehmigungen, einschließlich der Möglichkeit künftiger Verluste, mit komplexer Herstellung, hohen Qualitätsanforderungen, Abhängigkeit von begrenzten Bezugsquellen, Wettbewerb, technologischen Veränderungen, staatlichen Auflagen, Rechtsstreitigkeiten, künftigem Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie anderen Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission (SEC) hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und der nachfolgend bei der SEC eingereichten Unterlagen, dargelegt werden. Den Lesern dieser Pressemitteilung wird geraten, zukunftsgerichtete Aussagen, die ausschließlich den Informationsstand am Tag der Veröffentlichung widerspiegeln, nicht als verlässliche Informationen zu bewerten. Das Unternehmen ist nicht dazu verpflichtet, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch die Einwirkung unvorhersehbarer Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Contacts
Tom Langford
Director of Communication
(978) 882-8408
TLangford@abiomed.com