PROTECT III-Studie zufolge führt Einsatz von Impella vor risikoreicher PCI zu geringerer Sterblichkeitsrate im Vergleich zu Bailout-PCI
PROTECT III-Studie zufolge führt Einsatz von Impella vor risikoreicher PCI zu geringerer Sterblichkeitsrate im Vergleich zu Bailout-PCI
Frauen sind unverhältnismäßig stark von Notfallintervention betroffen
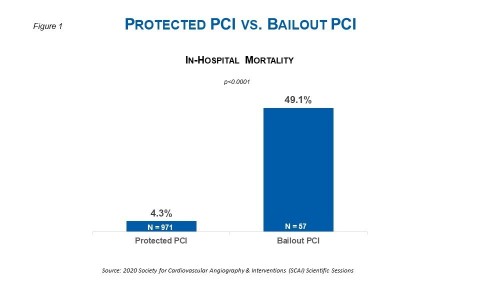
DANVERS, Massachusetts, USA--(BUSINESS WIRE)--Daten von mehr als 1.000 Patienten zufolge, die während der virtuellen Scientific Sessions der Society for Cardiovascular Angiography & Interventions (SCAI) vorgestellt wurden, kann die Impella Herzpumpe die Mortalität im Krankenhaus reduzieren, wenn sie vor einer nicht dringenden perkutanen Koronarintervention (PCI) eingesetzt wird. Wie in der Onlinepräsentation dargelegt hat die Studie den Nachweis erbracht, dass bei einer Hochrisiko-PCI eine zehnmal niedrigere Krankenhaussterblichkeit erreicht werden kann, wenn Impella vor einer PCI eingesetzt wird, verglichen mit der Platzierung während einer Bailout-PCI (siehe Abbildung 1). Eine Bailout-PCI ist ein Eingriff, bei dem der Arzt / die Ärztin eine elektive oder dringende PCI beginnt, ohne die Absicht, die Impella Herzpumpe einzusetzen, und dann während des Eingriffs die Impella Unterstützung einleitet, wenn der Patient bzw. die Patientin hämodynamisch instabil wird.
Die vorgestellten Daten stammen aus einer Begleitstudie zu PROTECT III, der laufenden, prospektiven FDA-Post-Approval-Studie für Impella bei Hochrisiko-PCI. Verfasser der Studie sind William O‘Neill, MD, ärztlicher Direktor des Center for Structural Heart Disease am Henry Ford Hospital, und Jeffrey W. Moses, MD, Direktor für interventionelle kardiovaskuläre Therapeutika und Professor für Medizin am Columbia University Medical Center.
Die Autoren der Studie berichten: „Die Impella Unterstützung bei hämodynamisch stabilen Patienten, die sich einer nicht dringenden PCI unterziehen – auch als ‚Protected PCI‘ bekannt – ist jetzt eine hinreichend belegte Indikation für eine spezifische Patientenpopulation, bei der ein hohes Risiko für einen hämodynamischen Kollaps während der PCI besteht. Dennoch verzichten manche Ärzte auf eine präventive hämodynamische Unterstützung und bevorzugen die Option einer Bailout-PCI für den Fall eines hämodynamischen Kollapses.“ Ziel der Studie war es, das Risiko dieser Vorgehensweise zu quantifizieren.
Die Studie untersuchte 1.028 Patienten, die Unterstützung durch Impella 2.5 oder Impella CP erhielten (971 in der Gruppe mit nicht dringender PCI und 57 in der Gruppe mit Bailout-PCI). In der Bailout-Gruppe waren Frauen stärker vertreten (50,9 % vs. 27,2 %, p = 0,0002), der mediane Ausgangswert der linksventrikulären Ejektionsfraktion war signifikant höher (40 % vs. 30 %, p < 0,0001), eine Herzinsuffizienz trat seltener auf (42,1 % vs. 56,9 %, p = 0,039), und auch die Hauptstammstenose war weniger prävalent (40,0 % vs. 56,1 %, p = 0,03). Zusammenfassend lässt sich festhalten, dass die Bailout-Gruppe einen höheren Frauenanteil aufwies, die Patienten jünger waren und eine höhere Ejektionsfraktion mit weniger Fällen von Herzinsuffizienz aufwiesen. Trotz dieser Unterschiede führte die Studie zu folgender Erkenntnis:
- Die Sterblichkeit im Krankenhaus war in der Bailout-Gruppe signifikant höher als in der Gruppe mit Protected PCI (49,1 % vs. 4,3 %, p < 0,0001). Der Unterschied bei der Mortalitätsrate war signifikant bei Patienten, die einen hämodynamischen Kollaps als Folge einer refraktären Hypotonie oder einer koronaren Perforation/Dissektion erlitten.
„Das Versäumnis, prospektiv Patienten zu identifizieren, bei denen ein hämodynamischer Kollaps während einer nicht dringenden PCI auftreten könnte, resultiert in einer unnötig hohen Mortalitätsrate im Krankenhaus. Wie die Daten belegen, kann eine Impella Unterstützung vor Einleitung der PCI dieses Risiko verringern“, so Dr. O‘Neill.
„Viele dieser Patienten, die eine Impella Unterstützung benötigen, sind jüngere Frauen mit ausreichenden Ejektionsfraktionen, für die deshalb oft keine mechanische Unterstützung in Betracht gezogen wird“, berichtet Dr. Cindy Grines, MD, Chief Scientific Officer am Northside Hospital Cardiovascular Institute in Atlanta. „Allerdings tolerieren diese Patientinnen möglicherweise keine anhaltende Ischämie während einer PCI. Dementsprechend sollten wir Frauen als gefährdete Bevölkerungsgruppe behandeln und im Vorfeld eine mechanische Unterstützung in Erwägung ziehen.“
Beim Einsatz von Impella besteht zudem die Möglichkeit einer vollständigen Revaskularisierung bei Hochrisikopatienten, wie in der SCAI-Positionserklärung 2020 zur optimalen perkutanen koronaren Interventionstherapie bei komplexer koronarer Herzkrankheit ausgeführt wird. In den SCAI-Richtlinien, die am Donnerstag veröffentlicht wurden, heißt es: „Beobachtungsstudien zeigen eine verbesserte prozedurale kardiovaskuläre Hämodynamik und eine vollständigere Revaskularisierung bei der Anwendung von MCS-Geräten (Mechanical Circulatory Support), selbst bei Patienten mit höherem Risikoprofil.“
ÜBER IMPELLA HERZPUMPEN
Impella 2.5® und Impella CP® sind von der FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen zugelassen, die einer elektiven oder dringlichen perkutanen Koronarintervention (PCI: Percutaneous Coronary Intervention) wie z. B. Stentimplantation oder Ballon-Anglioplastie unterzogen werden. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit SmartAssist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkten oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Die Impella RP® ist von der US-amerikanischen Zulassungsbehörde FDA zur Behandlung von Rechtsherzinsuffizienz oder Dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation oder Operation am offenen Herzen zugelassen. Impella ist das am intensivsten erforschte mechanische Kreislaufunterstützungssystem in der Geschichte der FDA. In FDA-Studien von insgesamt mehr als zehn Jahren zu Impella wurden Daten von mehr als 140.000 Patienten erhoben und mehr als 650 von Experten geprüfte Dokumente veröffentlicht.
In Europa sind Impella 2.5, Impella CP und Impella CP mit SmartAssist für eine bis zu fünftägige Behandlung von Hochrisiko-PCI- und AMI-Patienten mit kardiogenem Schock CE-zertifiziert. Impella 5.0 und Impella LD sind CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 10 Tage lang zu behandeln. Die Impella 5.5® mit Smart Assist® ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 30 Tage lang zu behandeln. Die Impella RP ist CE-gekennzeichnet, um Rechtsherzversagen oder Dekompensation nach Implantation des linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie zu behandeln.
Nähere Informationen über die Impella-Plattform von Herzpumpen, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen zur Anwendung der Geräte, finden Sie unter https://protect-us.mimecast.com/s/QpvSCJ6lPOHZLAMIk0HzL?domain=impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen die Entlastung, Heilung und Regeneration des Herzens durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens ermöglichen. Weitere Informationen erhalten Sie im Internet unter https://protect-us.mimecast.com/s/ZxRaCL9nPQHKMw8IAOs3n?domain=abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssit und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA und bestimmten anderen Ländern eingetragen. Impella BTR, Impella ECP, CVAD Study und sind angemeldete Marken von Abiomed, Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsbezogene Aussagen in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von ABIOMED, das kommerzielle Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende regulatorische Genehmigungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unwägbarkeiten im Zusammenhang mit Umfang, Ausmaß und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Genehmigungen, einschließlich der Möglichkeit künftiger Verluste, komplexe Herstellung, hohe Qualitätsanforderungen, Abhängigkeit von begrenzten Versorgungsquellen, Wettbewerb, technologische Veränderungen, staatliche Auflagen, Rechtsstreitigkeiten, künftiger Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie andere Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und der nachfolgend bei der SEC eingereichten Unterlagen, detailliert angegeben sind. Den Lesern dieser Pressemitteilung wird geraten, zukunftsbezogene Aussagen, die ausschließlich den Informationsstand am Tag der Veröffentlichung widerspiegeln, nicht als verlässliche Informationen zu bewerten. Das Unternehmen ist nicht dazu verpflichtet, Aktualisierungen dieser zukunftsbezogenen Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch die Einwirkung unvorhersehbarer Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Contacts
**Ansprechpartner bei Rückfragen:
Tom Langford
Director of Communication
978-882-8408
tlangford@abiomed.com