PARIS--(BUSINESS WIRE)--Regulatory News:
GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique spécialisée dans le développement et la commercialisation de thérapies géniques innovantes pour les maladies neurodégénératives rétiniennes et les troubles du système nerveux central, annonce aujourd'hui que les données d'efficacité et de tolérance des patients atteints de Neuropathie Optique Héréditaire de Leber et porteurs de la mutation ND4 (NOHL-ND4) traités par lenadogene nolparvovec (LUMEVOQ®, GS010) dans le cadre de programmes d'Accès Précoce (Early Access Program, EAP), ont été présentées lors du 49ème Congrès Annuel de la North American Neuro-Ophthalmology Society (NANOS). Les données ont été recueillies auprès des EAPs aux États-Unis, en France, en Italie et au Royaume-Uni.
« Il est important de noter que les données d'efficacité et de tolérance issues de ces programmes d'accès précoce sont cohérentes avec ce que LUMEVOQ a démontré dans ses essais cliniques, et qu'elles confirment LUMEVOQ comme étant une réelle option pour les patients atteints de NOHL et présentant la mutation ND4 », a déclaré le Dr Catherine Vignal-Clermont, Chef du Service de Neuro-Ophtalmologie et des Urgences Ophtalmologiques à l'Hôpital de la Fondation Rothschild à Paris et du Service d’Ophtalmologie, de Neuro-Ophtalmologie et d’Oculomotricité du Centre Hospitalier National d’Ophtalmologie des Quinze-Vingts à Paris. « J'ai été ravie de partager ces données avec l'ensemble de la communauté scientifique et médicale lors du prestigieux congrès du NANOS. »
Lenadogene nolparvovec a été mis à disposition dans les pays respectifs via les EAPs sur la base de demandes spontanées de cliniciens et de patients, et son usage autorisé par les autorités locales. Entre août 2018 et mars 2022, 63 patients NOHL-ND4 ont reçu des injections intravitréennes de lenadogene nolparvovec, 67% des patients ayant reçu des injections dans les deux yeux (traitement bilatéral), tandis que 33% des patients ont reçu une injection dans un œil (traitement unilatéral). Les données individuelles de 45 des 63 patients ayant passé le cap de l'année post-traitement et ayant effectué leur visite à un an ont été regroupées et analyséesa.
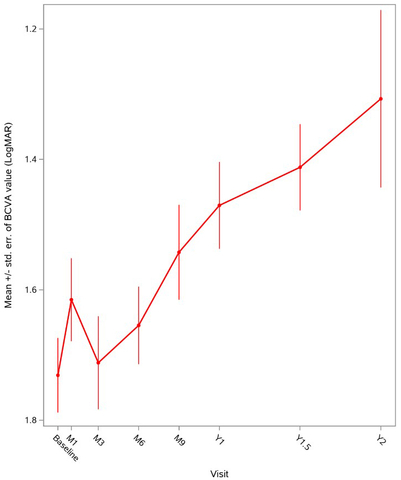
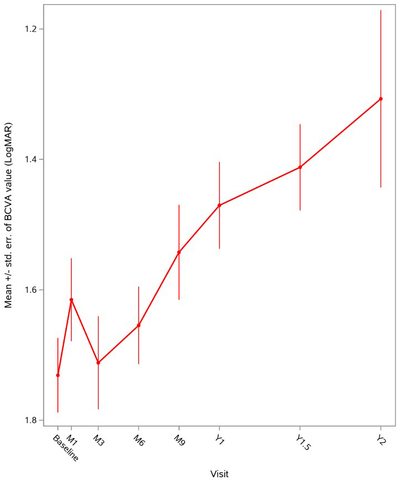
Les données ont confirmé l'efficacité et le profil de tolérance de LUMEVOQ® en situation de vie réelle. Le changement moyen de variation de l’acuité visuelle (BCVA) un an après le traitement dans tous les yeux était une amélioration de 22,5 lettres ETDRS (-0,45 LogMAR) par rapport au nadir (c.à.d. : la moins bonne acuité visuelle enregistrée entre la baseline et la première année). L'amélioration était meilleure chez les patients ayant reçu des injections bilatérales, avec une amélioration moyenne de l’acuité visuelle de 24,5 lettres ETDRS (-0,49 LogMAR) par rapport au nadir, contre 19,5 lettres ETDRS (-0,39 LogMAR) pour les patients traités unilatéralement.
Figure 1 : Evolution globale de la variation de l’acuité visuelle (BCVA) moyenne sur deux ans chez les patients ayant reçu LUMEVOQ® dans le cadre de programmes d'accès précoce.
[Graphique inclus ci-dessus]
|
Baseline |
Mois 1 |
Mois 3 |
Mois 6 |
Mois 9 |
Année 1 |
Année 1.5 |
Année 2 |
Nombre d’yeux |
124 |
107 |
107 |
103 |
88 |
90 |
34 |
14 |
Les analyses des répondeurs démontrent une amélioration cliniquement significative de l’acuité visuelle pour une grande proportion des yeux des patients. Un an après le traitementa, 64% des yeux présentaient une amélioration d'au moins 15 lettres ETDRS (0,3 LogMAR) par rapport au nadir et 60% des yeux ont atteint une récupération cliniquement pertinente (Clinically Relevant Recovery, CRR) par rapport au nadir.
Les résultats de tolérance obtenus dans les EAP étaient cohérents avec ceux observés dans les études cliniques, montrant un profil de sécurité favorable du lenadogene nolparvovec. Notamment, les cas d'inflammation intraoculaire signalés dans les yeux traités par LUMEVOQ® étaient comparables, en termes de fréquence, d'intensité et de localisation, à ceux observés dans les études cliniques.
Bernard Gilly, Directeur Général et Co-fondateur de GenSight Biologics, a déclaré : « Ces données réelles viennent s'ajouter à notre corpus croissant de preuves cliniques dans lequel LUMEVOQ a démontré à plusieurs reprises sa capacité à améliorer en toute sécurité l'acuité visuelle chez les patients atteints de NOHL-ND4 et perdant rapidement la vue. Nous concentrons à présent tous nos efforts pour mettre à disposition dès que possible ce traitement innovant à l'ensemble de la population atteinte de NOHL-ND4. »
Les données d'efficacité et de tolérance des EAPs pour les patients atteints de NOHL-ND4 ont été présentées par le Dr Catherine Vignal-Clermont, dans le cadre d’un poster, lors du Congrès du NANOS qui se tient à Orlando, en Floride, du 11 au 16 mars 2023.
- Présentation: "Use of Lenadogene Nolparvovec Gene Therapy for Leber Hereditary Optic Neuropathy in Early Access Programs"
- Présentation du poster par le Dr Catherine Vignal-Clermont
- Session : Études analytiques (numéro de poster : 279)
- Mardi 14 mars 2023, 18h30 - 19h30 EST
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intravitréenne dans chaque œil. Développé dans le traitement de la neuropathie optique héréditaire de Leber (NOHL), le principal produit candidat de GenSight Biologics, LUMEVOQ® (GS010 ; lenadogene nolparvovec), est en cours d'examen pour enregistrement en Europe, et en phase III préalablement au dépôt de la demande d’autorisation de mise sur le marché aux Etats-Unis (Biologics License Application [BLA]). LUMEVOQ® (GS010 ; lenadogene nolparvovec), n'a été enregistré dans aucun pays à ce stade ; une demande d'autorisation de mise sur le marché est actuellement en cours d’examen par l'EMA pour le traitement de la neuropathie optique héréditaire de Leber (LHON).
À propos de LUMEVOQ® (GS010 ; lenadogene nolparvovec)
LUMEVOQ® (GS010 ; lenadogene nolparvovec) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision à Paris, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne des Médicaments (EMA) en octobre 2018. LUMEVOQ® (GS010 ; lenadogene nolparvovec), n'a été enregistré dans aucun pays à ce stade ; une demande d'autorisation de mise sur le marché est actuellement en cours d’examen par l'EMA pour le traitement de la neuropathie optique héréditaire de Leber (LHON).
______________________
a L'analyse un an après traitement pourrait être mise à jour à l'avenir avec des yeux évaluables supplémentaires quand plus de patients auront atteint une année après traitement et effectué leur visite à un an.