米マサチューセッツ州ダンバース--(BUSINESS WIRE)--(ビジネスワイヤ) -- 急性心筋梗塞に伴う心原性ショック(AMICS)患者を対象とした2つの研究で、PCI前にImpellaを留置した場合、PCI後にImpellaを留置した場合と比較して生存率が高いことが明らかになりました。これらの研究結果は、心臓血管研究財団の第32回年次科学シンポジウムであるTCTコネクトで発表されました。
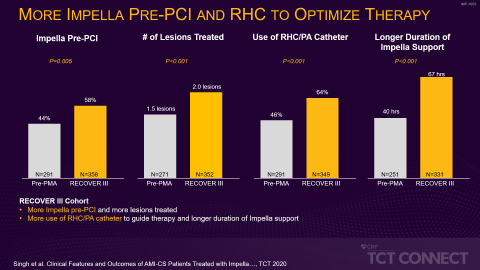
1件目の研究はアセンション・セント・ジョン病院のHemindermeet Singh医師が発表したもので、研究者らは2つのコホートの患者649人の比較を行いました。これらのコホートは、PCI前にImpellaを留置するベストプラクティスが広く採用された後のRECOVER III市販後承認(PMA)試験の最近のコホート(2017~2019年)と、PCI前にImpellaを留置するベストプラクティスがまだ広く採用されていなかったPMA前のコホート(2008~2014年)です。研究者らは最近のコホートで全生存率が相対的に18%改善し、PCI前のImpella留置に伴う利点を示しました。また最近のコホートではPCI周術期の急性腎障害(AKI)および大出血または血管合併症の発現率低下が明らかになりました。最近のコホートでは高血圧症、喫煙、脳卒中、ニューヨーク心臓協会(NYHA)の心機能分類でクラスIII/IVの心不全の割合が高かったにもかかわらずこのような結果が得られました(図1参照)。
本研究の上席著者を務めたAmir Kaki医師(アセンション・セント・ジョン病院、インターベンション心臓専門医、機械的循環補助ディレクター)は、次のように述べています。「本データは、過去3年間にわたって心原性ショックに対するベストプラクティスの採用が増えたことにより、全生存率が改善されたことを示しています。患者さんの転帰を改善するために医師にとって重要なのは、心原性ショックの早期確認、右心カテーテルの使用、毒性のある強心薬の減量、PCI前のImpella使用を含め、これらのベストプラクティスを適用することです。」
また、Singh医師は次のように述べています。「本研究は、医師と医療機関が経験を積んでいることを示しています。心原性ショックに対する標準化プロトコルの導入と、血管合併症および出血性合併症を減らす戦略の採用増加は、生存率の改善に結び付いています。これらの要因を深く理解することは、社会全体で心原性ショック患者さんの転帰を改善する上で大きな可能性を持っています。」
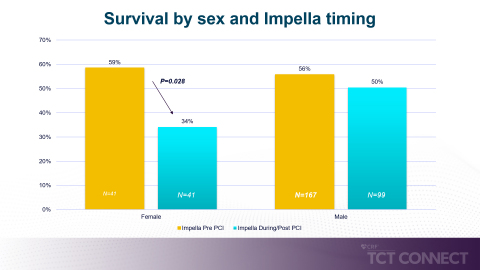
2つ目の研究はイェール大学メディカルスクールのTayyab Shah医師が発表したもので、2017~2019年にRECOVER III試験で収集されたデータが分析されました。本研究では、AMICS患者でPCI前にImpellaを留置した場合、PCI後に留置した場合に比較して、特に女性で高い生存率に結び付くことが示されました。研究者らは、女性患者がPCI前にImpellaを使用した場合、PCI後の留置と比較して74%の相対的な生存率の向上が認められたとしています。著者らはImpellaの早期の留置が、特に女性の場合、大きな生存率向上の利点をもたらすと結論付けました。(図2参照)
Shah医師は次のように述べています。「本研究は、PCIおよび循環作動薬/強心薬の使用前に、心原性ショック患者に対する補助としてImpellaデバイスを早期使用することが、特に女性患者に生存上の利点をもたらし得ることを示しています。これは観察研究から得た結果として興味深く、臨床的に意義があり、今度のRECOVER IVランダム化対照試験でさらに検討される必要があります。」
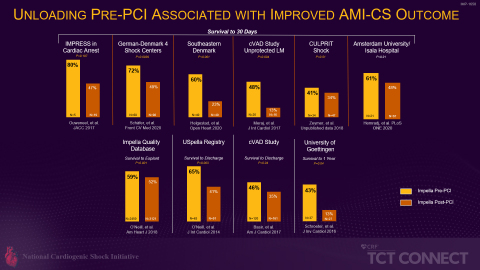
FDA PMA承認以来、アビオメッド(NASDAQ: ABMD)は米国のImpella使用患者のほぼ100%のデータを観察的なImpella Quality(IQ)データベースに収集してきました。この臨床データは、アビオメッドの前向きIRB承認カテーテル型補助人工心臓(cVAD)研究に組み込んだRECOVER IIIなどのFDA承認後研究のデータと組み合わされ、生存率の改善と自己心機能の回復につながるImpella使用のベストプラクティスを確認・実証する上で役立ちました。これらのベストプラクティスは、PCI前のImpella使用、心原性ショックの早期確認、強心薬の減量、肺動脈カテーテルによる血行動態モニタリングを含むもので、現在、複数の論文で実証されています。(図3参照)
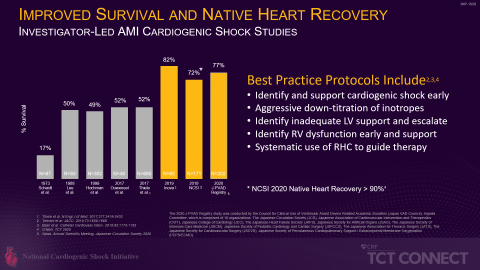
さらに、National Cardiogenic Shock Initiative Study(NCSI)、Inova試験(Tehrani et al)、日本の「補助循環用ポンプカテーテルに関するレジストリ事業」など、PCI前のImpella留置を含むベストプラクティスのプロトコルによる独立した医師主導研究で、過去の心原性ショック後の生存率と比較して大幅な生存率向上が示されています(図4参照)。これらのベストプラクティスは、AMICS患者におけるImpellaのRECOVER IVランダム化対照試験の試験プロトコルに必要な情報を提供するものとなります。など、PCI前のImpella留置を含むベストプラクティスのプロトコルによる独立した医師主導研究で、過去の心原性ショック後の生存率と比較して大幅な生存率向上が示されています(図4参照)。これらのベストプラクティスは、AMICS患者におけるImpellaのRECOVER IVランダム化対照試験の試験プロトコルに必要な情報を提供します。
AMICSの治療におけるベストプラクティスを共有するために、アビオメッドはTCTコネクトにて、2020年10月18日(日曜)米国東部夏時間午前10時00分に、「70%を超えるAMICS生存率の達成:世界各国のベストプラクティス」と題するシンポジウムを開催します。シンポジウムの司会を務めるのは、ヘンリー・フォード病院の心疾患センターでメディカルディレクターを務めるウィリアム・オニール医師(MD)です。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術またはバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国食品医薬品局(FDA)より市販前承認(PMA)を取得している心内留置型ポンプです。Impella 2.5、Impella CP、SmartAssist®搭載Impella CP、Impella 5.0®、Impella LD®、SmartAssist®搭載Impella 5.5™は、心原性ショック状態にある急性心不全心筋症患者の治療に使用する心臓ポンプとして米国食品医薬品局(FDA)の承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。Impella RP®は、右室不全および左心補助人工心臓の埋込、心筋梗塞、心臓移植、開胸手術後に発生する非代償性心不全の治療を目的として米国食品医薬品局(FDA)の承認を受けています。またImpella RPは、病院環境における医療提供者(HCP)による緊急使用として、体表面積1.5 m2以上の救急患者さんを対象に最長14日間までの一時的な右心室補助の実施、さらには肺塞栓症(PE)を含め、コロナウイルス感染症(COVID-19)と関連した合併症に起因する急性右心不全または代償不全の治療を目的とした使用も認められています。Impella RPはCOVID-19と関連した合併症に起因する急性右心不全または代償不全の治療用として承認されていません。またImpella Left Ventricular(LV、左室)補助装置は、COVID-19に感染していることが確認され、ECMO治療を受け、静脈-動脈(V-A)ECMO補助療法中に肺水腫を発症したか、静脈-静脈(V-V)ECMO補助療法中に心筋炎による遅発性心代償不全を発症した救急患者を治療するために病院環境における医療提供者(HCP)が一時的な(Impella 2.5、Impella CP、SmartAssist搭載Impella CPの場合4日以内、Impella 5.0、SmartAssist搭載Impella 5.5の場合14日以内)左室負荷軽減・補助のための緊急使用も許可されています。使用許可を受けたImpella左室補助装置は、許可された適応症に対し認可ないし承認されたわけではありません。Impella RPおよびImpella LVの補助装置は、上記の緊急使用につきEUAに基づくFDAの許可を受けており、許可が終了するか早期取り消しされない限り、連邦法 21 U.S.C. § 360bbb-3(b)(1)の564(b)(1)条に基づく医療機器の緊急使用許可を正当化する状況が存在するという宣言の期間中に限って許可されています。
欧州でImpella 2.5、Impella CP、SmartAssist搭載Impella CPは、高リスクPCIおよび心原性ショックショックを伴う急性心筋梗塞(AMI)の患者さんの最長5日間の治療を対象としてCEマークを取得しています。Impella 5.0およびImpella LDは、心原性ショックを伴う心臓発作または心筋症の患者さんの最長10日間の治療を対象としてCEマークを取得しています。SmartAssist®搭載Impella 5.5™は、急性心不全または心原性ショックを伴う心筋症の患者さんの最長30日間の治療を対象としてCEマークを取得しています。Impella RPは、右心不全および左心補助人工心臓埋込、心筋梗塞、心臓移植、開胸術後に発生する代償不全に陥った心不全の治療デバイスとしてCEマークを取得しています。
承認された適応症や、デバイスの使用に伴う重要な安全性・リスク情報を含め、Impella心臓ポンププラットフォームの詳細については、https://www.impella.com/をご覧ください
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、心臓のポンプ機能を補助することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはhttps://www.abiomed.com/impella をご覧ください。Abiomed、Impella、Impella 2.5、Impella 5.0、Impella 5.5、 Impella LD、Impella CP、Impella RP、SmartAssist、Impella Connectは、アビオメッドの登録商標で、米国および一定の外国で登録されています。Impella BTR、Impella 5.5、Impella ECP、CVAD Study、STEMI DTU Studyはアビオメッドが商標登録出願中です。
将来見通しに関する記述
本リリースは、アビオメッドの既存製品および新製品の開発、営業活動による企業としての成長、将来的可能性、および行政当局による承認の見込みに関する記述等の将来の見通しに関する記述が含まれます。当社の実績は多くの要因によりこの将来の見通しに関する記述の中で記載とは大きく異なる可能性があり、それらの要因には、COVID-19の世界的流行病がもたらす影響の範囲・規模・期間、開発、試験、関連行政当局による承認に伴う不確定要素(将来の損失の可能性を含む)、さらには将来的な損失が生じる可能性、複雑な製造工程、高品質に関する要件、限られた供給源への依存、競争、技術的変更、行政規制、訴訟問題、今後の資金需要と追加資金の不確実性に加え、直近に提出したForm 10-Kの年次報告書とその後SECに提出・提供した書類を含め、証券取引委員会に提出した当社の報告書に記載されたその他のリスクおよび課題が含まれます。利用者は、本プレスリリースの発表日時点に述べられている将来の見通しに関するいかなる記述についても過度に依拠することのないようお願いいたします。当社は、本プレスリリースの発行日以降に発生する事象、または予想外の出来事の発生によって、見通しまたは予測など、当社の将来の業績に関する見通しを更新し、または修正する義務を負うものではありません。これらの訂正は、本リリースの日付以降に発生する出来事や状況を反映させたり、予想外の出来事を反映させたりする場合に行われる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2020年10月16日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。