CAMBRIDGE, Massachusetts y OSAKA, Japón--(BUSINESS WIRE)--Takeda Pharmaceutical Company Limited (TSE:4502/NYSE:TAK) anunció hoy los datos actualizados del estudio de fase 3 ALTA-1L, que evaluó a ALUNBRIG versus crizotinib en adultos con cáncer de pulmón no microcítico avanzado (NSCLC) positivo para la quinasa del linfoma anaplásico (ALK+) que no habían recibido un inhibidor de ALK previo. Después de más de dos años de seguimiento, los resultados muestran que ALUNBRIG redujo el riesgo de progresión de la enfermedad o muerte en un 76% (relación de riesgo [HR] = 0,24, IC 95%: 0,12–0,45) tal como lo evaluaron los investigadores en pacientes recientemente diagnosticados cuya enfermedad se había diseminado al cerebro al momento del ingreso al estudio. ALUNBRIG también demostró una reducción del 57% (HR = 0,43, IC 95%: 0,31–0,61) en el riesgo de progresión de la enfermedad o muerte en todos los pacientes. Estos datos se presentarán el sábado 23 de noviembre en Singapur, durante la Sesión Presidencial en el Congreso 2019 de la Sociedad Europea para Oncología Médica (ESMO) de Asia.
Los resultados del estudio ALTA-1L fueron evaluados por dos organismos de revisión separados (los investigadores del estudio y un comité de revisión independiente con ciego [BIRC]) y se informaron los resultados de ambas evaluaciones. En el corte de datos para el segundo análisis provisorio (28 de junio de 2019), la HR evaluada por el BIRC de sobrevida libre de progresión (PFS), que es el punto de referencia primario, fue de 0,49 (IC 95%: 0,35–0,68, rango de registro P<0,0001), y demostró un riesgo reducido de progresión de la enfermedad o muerte de 51%.
“Dada la complejidad de esta enfermedad y la longevidad esperada de la población, para los médicos es importante tener opciones de tratamiento múltiples bien toleradas y duraderas para satisfacer las necesidades de sus pacientes”, dijo D. Ross Camidge, M.D., Ph.D., titular de la cátedra Joyce Zeff en investigación del cáncer de pulmón en el Centro de Cáncer de la Universidad de Colorado e investigador principal de ALTA-1L. “Con 25 meses de seguimiento desde el estudio ALTA-1L, brigatinib continúa demostrando efectividad total e intracraneana, mientras que mejora significativamente la calidad de vida en comparación con crizotinib, reforzando su potencial como tratamiento de primera línea para ALK+ NSCLC”.
Los datos adicionales del análisis de largo plazo demostraron que los pacientes recién diagnosticados tratados con ALUNBRIG se beneficiaron independientemente de la presencia o ausencia de metástasis cerebral en el nivel basal, que es uno de los sitios más comunes de primera progresión y que se asocia con mala calidad de vida.
-
ALUNBRIG demostró respuestas altas y duraderas en el cerebro, en pacientes con metástasis cerebrales basales, con eficacia superior comparado con crizotinib, tal como lo evaluó el BIRC, y se observó una separación temprana de las curvas de PFS en estos pacientes.
- ALUNBRIG redujo el riesgo de progresión de enfermedad intracraneana o muerte en un 69% en pacientes con metástasis cerebrales en el nivel basal (HR = 0,31, IC 95%: 0,17–0,56), con una PFS media intracraneana de 24 meses comparada con 5,6 meses con crizotinib. La PFS media para pacientes con metástasis cerebrales en el nivel basal no se alcanzó con ALUNBRIG y fue de 5,9 meses con crizotinib, según evaluación de los investigadores.
- La tasa de respuesta objetiva (ORR) intracraneana confirmada para pacientes con metástasis cerebrales mensurables en el nivel basal fue de 78% (IC 95%: 52,4–93,6) para pacientes tratados con ALUNBRIG y de 26% (IC 95%: 10,2–48,4) para pacientes tratados con crizotinib.
- La duración de respuesta (DOR) media intracraneana en respondedores confirmados con metástasis cerebrales mensurables en el nivel basal no fue alcanzada (IC 95%: 5,7–NE) con ALUNBRIG y fue de 9,2 meses (IC 95%: 3,9–9,2) con crizotinib.
-
ALUNBRIG demostró eficacia total consistente (población con intención de tratamiento) con un seguimiento más prolongado de 25 meses.
- La PFS media con ALUNBRIG fue de 29,4 meses (IC 95%: 21,2–NE) versus 9,2 meses (IC 95%: 7,4–12,9) con crizotinib, según fue evaluada por los investigadores. La PFS media evaluada por el BIRC fue de 24,0 meses (IC 95%: 18,5–NE) para ALUNBRIG y 11,0 meses (IC 95%: 9,2–12,9) para crizotinib.
- La ORR confirmada fue de 74% (IC 95%: 65,5–80,9) para ALUNBRIG y 62% (IC 95%: 52,9–69,7) para crizotinib, según evaluó un BIRC.
- La DOR media no se alcanzó (IC 95%: 19,4–NE) con ALUNBRIG y fue de 13,8 meses (IC 95%: 9,3–20,8) con crizotinib, según evaluó un BIRC.
-
También se evaluó la calidad de vida (QoL) para los pacientes recién diagnosticados con ALK+ NSCLC, con resultados que mostraron que los pacientes tratados con ALUNBRIG experimentaron mejoras significativas en la QoL de relacionada con la salud (HRQoL).
- ALUNBRIG demoró el tiempo medio hasta el empeoramiento en el Puntaje de Salud Global (puntaje GHS)/QoL (≥10 puntos de empeoramiento del puntaje) en 27 meses versus 8 meses con crizotinib.
- Los pacientes tratados con ALUNBRIG tuvieron mayor duración de la mejoría en GHS/ QoL, con la duración de mejoría que todavía no se alcanzó en comparación con 12 meses con crizotinib.
- ALUNBRIG también retardó el tiempo de empeoramiento y duración prolongada de mejoría en subescalas múltiples como la fatiga, náuseas y vómitos, pérdida de apetito y funcionamiento emocional y social.
“En Takeda, estamos comprometidos en desarrollar productos que buscan mejorar el panorama de tratamientos contra el cáncer de pulmón y atender las necesidades no satisfechas de los pacientes”, afirmó Phil Rowlands, Jefe de la Unidad del Área Terapéutica Oncológica. “Estamos orgullosos del progreso logrado hasta este momento, incluidos estos resultados actualizados de la prueba ALTA-1L, donde se demuestra que ALUNBRIG retrasó más de dos años la progresión de la enfermedad y redujo significativamente el riesgo de progresión de la enfermedad en pacientes con metástasis cerebrales en el nivel basal. Esperamos poder enviar estos datos a las autoridades regulatorias de todo el mundo con el objetivo de que ALUNBRIG esté disponible para pacientes con ALK+ NSCLC a nivel global”.
“Las necesidades de tratamiento individuales para los pacientes con ALK+ NSCLC son diversas porque el cáncer no es una enfermedad que se expresa igual en todos los pacientes”, dijo Bonnie Addario, Cofundadora y Presidenta de la Junta Directiva de la Fundación GO2 para el Cáncer de Pulmón. “La investigación y los estudios clínicos en curso, como ALTA-1L, son críticos para lograr nuestro objetivo de mejorar los resultados y la calidad de vida para los pacientes al comienzo de su recorrido de tratamiento. Agradecemos a los pacientes, los familiares y los investigadores que participaron en este estudio clínico, que muestra resultados para quienes son recién diagnosticados con ALK+ NSCLC”.
El perfil de seguridad de ALUNBRIG en el estudio ALTA-1L fue generalmente consistente con la información de prescripción de EE. UU.
- Los eventos adversos emergentes del tratamiento más comunes (TEAE) Grado ≥3 en el brazo de ALUNBRIG fueron: aumento de CPK (24,3%), aumento de lipasa (14.0%) e hipertensión (11,8%); y para crizotinib fueron: aumento de ALT (10,2%), AST (6,6%) y lipasa (6,6%).
- La frecuencia de los eventos pulmonares tempranos (enfermedad pulmonar intersticial/neumonitis) en el estudio ALTA-1L fue apenas menor comparada con el estudio ALTA en una población post crizotinib.
- Los eventos pulmonares en cualquier momento ocurrieron en 5,1% de los pacientes en el brazo ALUNBRIG y 2,2% en el brazo crizotinib.
- La discontinuación debida a AE ocurrió en 12,5% de los pacientes en el brazo ALUNBRIG y 8,8% en el brazo crizotinib.
- Actualmente ALUNBRIG no está aprobado para uso en la primera línea.
Acerca del estudio ALTA-1L
El estudio de ALUNBRIG de fase 3 ALTA-1L (ALK en Estudio de cáncer de pulmón de Brigatinib en 1a línea) en adultos es un estudio global, en curso, aleatorizado, de etiqueta abierta, comparativo, multicéntrico, que inscribió a 275 pacientes (ALUNBRIG, n=137, crizotinib, n=138) con cáncer de pulmón no microcítico (NSCLC), positivo para la quinasa del linfoma anaplásico (ALK+) avanzado localmente o metastásico que no habían recibido tratamiento previo con un inhibidor de ALK. Los pacientes recibieron ALUNBRIG, 180 mg una vez al día con una dosis inicial durante siete días, de 90 mg una vez al día, o crizotinib, 250 mg dos veces al día.
La edad media fue de 58 años en el brazo ALUNBRIG y 60 años en el brazo crizotinib. Veintinueve por ciento de los pacientes tenían metástasis cerebrales en el nivel basal en el brazo ALUNBRIG versus 30% en el brazo crizotinib. Veintiséis por ciento de los pacientes recibieron quimioterapia previa por enfermedad avanzada o metastásica en el brazo ALUNBRIG versus 27% en el brazo crizotinib.
La sobrevida libre de progresión (PFS) evaluada por el comité de revisión independiente con ciego (BIRC) fue el punto de referencia primario. Los puntos de referencia secundarios incluyeron la tasa de respuesta objetiva (ORR) según RECIST v1.1, ORR intracraneana, PFS intracraneana, sobrevida total (OS), seguridad y tolerabilidad.
Acerca de ALUNBRIG® (brigatinib)
ALUNBRIG es un inhibidor potente y selectivo de la tirosina quinasa (TKI) de próxima generación (TKI) que fue diseñado para apuntar e inhibir la proteína de fusión quinasa del linfoma anaplásico (ALK) en el cáncer de pulmón no microcítico (NSCLC). En abril de 2017, ALUNBRIG recibió la Aprobación Acelerada de la Administración de Alimentos y Medicamentos (FDA) de EE. UU. para pacientes con NSCLC metastásico positivo para la quinasa (ALK+) del linfoma anaplásico que han progresado o son intolerantes a crizotinib. Esta indicación está aprobada bajo la Aprobación Acelerada basada en la tasa de respuesta tumoral y la duración de la respuesta. La aprobación continuada para esta indicación puede ser contingente a la verificación y descripción del beneficio clínico en un estudio confirmatorio.
ALUNBRIG actualmente está aprobado en más de 40 países, incluidos EE. UU., Canadá y la Unión Europea, para el tratamiento de las personas con ALK+ NSCLC metastásico cuya enfermedad ha empeorado durante el tratamiento con crizotinib o no pudieran tolerar la administración de crizotinib.
ALUNBRIG recibió la Designación de Terapia Innovadora de la FDA para el tratamiento de pacientes con ALK+ NSCLC cuyos tumores sean resistentes a crizotinib, y la FDA le otorgó la Designación de Droga Huérfana para el tratamiento de ALK+ NSCLC, ROS1+ y EGFR+ NSCLC.
Takeda en cáncer de pulmón
Takeda está dedicado a expandir la experiencia en los panoramas del tratamiento de ALK+ NSCLC y EGFR exon 20. Nuestros programas exhaustivos incluyen los siguientes estudios clínicos para continuar abordando las necesidades insatisfechas para las personas que viven con cáncer de pulmón:
Estudio de fase 1/2
- ALUNBRIG, que fue diseñado para evaluar la seguridad, tolerabilidad, farmacocinética y actividad antitumoral preliminar de ALUNBRIG.
- Estudio central de fase 2 ALTA, que investiga la eficacia y la seguridad de ALUNBRIG en dos regímenes de dosis en pacientes con ALK+ NSCLC avanzado localmente o metastásico que había progresado con crizotinib.
- Estudio de fase 3 global, aleatorizado ALTA-1L, que evalúa la eficacia y seguridad de ALUNBRIG en comparación con crizotinib en pacientes con ALK+ NSCLC avanzado localmente o metastásico que no han recibido tratamiento previo con un inhibidor de ALK.
- El estudio de fase 2 de brazo único, multicéntrico J-ALTA, en pacientes japoneses con ALK+ NSCLC, que se centra en pacientes que han progresado con alectinib. Actualmente se están reclutando pacientes en este estudio.
- Estudio de fase 2 global, de brazo único ALTA 2, que evalúa ALUNBRIG en pacientes con ALK+ NSCLC avanzado que han progresado con alectinib o ceritinib. Actualmente se están reclutando pacientes en este estudio.
- Estudio de fase 3 global, aleatorizado ALTA 3, que compara la eficacia y seguridad de ALUNBRIG versus alectinib en participantes con ALK+ NSCLC que han progresado con crizotinib. Actualmente se están reclutando pacientes en este estudio.
TAK-788
- Estudio de fase 1/2, que evalúa la seguridad, la farmacocinética y la actividad antitumoral de TAK-788 del inhibidor EGFR/HER2 en pacientes con NSCLC.
- EXCLAIM de fase 2, cohorte de extensión central del estudio de fase 1/2, que fue diseñado para evaluar la eficacia y la seguridad de TAK-788 a 160 mg una vez al día en pacientes previamente tratados con mutaciones de inserción EGFR exon 20. Este estudio está cerrado al reclutamiento.
- Estudio de fase 3, global, aleatorizado EXCLAIM 2, que evalúa la eficacia de TAK-788 como tratamiento de primera línea comparado con la quimioterapia con base de platino en el tratamiento de pacientes que nunca recibieron tratamiento con NSCLC localmente avanzado o metastásico cuyos tumores alojan las mutaciones de inserción EGFR exon 20.
- Estudio de fase 1, de etiqueta abierta, multicéntrico, con aumento de dosis que evalúa la seguridad, la tolerabilidad y la farmacocinética de TAK-788 en pacientes japoneses con NSCLC localmente avanzado o metastásico. Este estudio ya completó el reclutamiento.
- Estudio de fase 2, de etiqueta abierta, brazo único que evalúa la eficacia de TAK-788 en pacientes que no recibieron tratamiento con NSCLC localmente avanzado o metastásico cuyos tumores alojan las mutaciones de inserción de EGFR exon 20.
- Estudio de fase 1, de etiqueta abierta, de dos períodos, secuencia fija diseñado para caracterizar la interacción droga-droga entre TAK-788 y un inhibidor fuerte del citocromo P-450 (CYP)3A, itraconazol (Parte 1) o un inductor fuerte de CYP3A, rifampin (Parte 2) en pacientes adultos saludables.
Para información adicional sobre los estudios clínicos ALUNBRIG y TAK-788, visite www.clinicaltrials.gov.
Acerca de ALK+ NSCLC
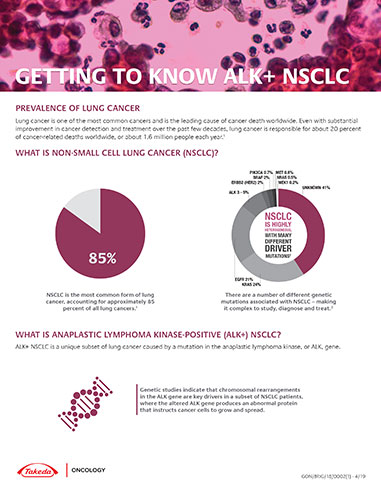
El cáncer de pulmón no microcítico (NSCLC) es la forma más común de cáncer de pulmón, que representa aproximadamente el 85% de los 1,8 millones de nuevos casos de cáncer de pulmón estimados que se diagnostican cada año en el mundo, de acuerdo con la Organización Mundial de la Salud.1,2 Los estudios genéticos indican que las redisposiciones cromosómicas en la quinasa del linfoma anaplásico (ALK) son impulsoras clave en un subconjunto de pacientes con NSCLC.3 Aproximadamente tres a cinco por ciento de los pacientes con NSCLC metastásicos tienen una redisposición en el gen de ALK.4,5,6
Takeda está comprometido con la continuidad de la investigación y el desarrollo en NSCLC para mejorar las vidas de los aproximadamente 40000 pacientes diagnosticados con esta forma grave y rara de cáncer de pulmón en el mundo cada año.7
INFORMACIÓN IMPORTANTE DE SEGURIDAD DE ALUNBRIG
ADVERTENCIAS Y PRECAUCIONES
Enfermedad pulmonar intersticial (ILD)/Neumonitis: Se han producido reacciones pulmonares adversas severas, potencialmente fatales y fatales consistentes con enfermedad pulmonar intersticial (ILD)/neumonitis con ALUNBRIG. En el estudio ALTA (ALTA), la ILD/neumonitis ocurrió en 3,7% de los pacientes en el grupo de 90 mg (90 mg una vez al día) y 9,1% de los pacientes en el grupo de 90→180 mg (180 mg una vez al día con 7 dosis iniciales de 90 mg una vez al día). Las reacciones adversas consistentes con posible ILD/neumonitis ocurrieron temprano (dentro de los 9 días de iniciación de ALUNBRIG; la media del comienzo fue de 2 días) en 6,4% de los pacientes, con reacciones de Grado 3 a 4 que ocurren en 2,7%. Monitorear para ver nuevos síntomas respiratorios o empeoramientos (por ej., disnea, tos, etc.), particularmente durante la primera semana de inicio de ALUNBRIG. Suspender ALUNBRIG en todos los pacientes con síntomas respiratorios nuevos o que empeoran, y evaluar rápidamente ILD/neumonitis u otras causas de síntomas respiratorios (por ej., embolismo pulmonar, progresión del tumor y neumonía infecciosa). Para ILD/neumonitis de Grado 1 o 2, o bien reiniciar ALUNBRIG con reducción de dosis después de la recuperación al nivel basal o discontinuar permanentemente ALUNBRIG. Discontinuar permanentemente ALUNBRIG para ILD/neumonitis de Grado 3 o 4 o recurrencia de ILD/neumonitis de Grado 1 o 2.
Hipertensión: En ALTA, se informó hipertensión en 11% de los pacientes en el grupo de 90 mg que recibieron ALUNBRIG y 21% de los pacientes en el grupo de 90→180 mg. La hipertensión de Grado 3 ocurrió en 5,9% del total de pacientes. Controlar la presión arterial antes del tratamiento con ALUNBRIG. Monitorear la presión arterial después de 2 semanas y al menos mensualmente de allí en adelante durante el tratamiento con ALUNBRIG. Suspender ALUNBRIG por hipertensión de Grado 3 a pesar de la óptima terapia antihipertensiva. Al resolver o mejorar la severidad a Grado 1, reiniciar ALUNBRIG a una dosis reducida. Considerar la discontinuación permanente del tratamiento con ALUNBRIG para hipertensión de Grado 4 o recurrencia de hipertensión de Grado 3. Tener precaución al administrar ALUNBRIG en combinación con agentes antihipertensivos que causan bradicardia.
Bradicardia: Puede producirse bradicardia con ALUNBRIG. En ALTA, las frecuencias cardíacas menores de 50 latidos por minuto (bpm) ocurrieron en 5,7% de los pacientes en el grupo de 90 mg y 7,6% de los pacientes en el grupo de 90→180 mg. La bradicardia de Grado 2 ocurrió en 1 (0,9%) paciente en el grupo de 90 mg. Monitorear la frecuencia cardíaca y la presión arterial durante el tratamiento con ALUNBRIG. Monitorear a los pacientes con más frecuencia si se utilizan concomitantemente medicamentos que producen bradicardia y no se pueden evitar. Para bradicardia sintomática, suspender ALUNBRIG y revisar los medicamentos concomitantes para chequear aquellos que causan bradicardia. Si se sabe que un medicamento concomitante produce bradicardia y se lo identifica y discontinúa o se ajusta la dosis, reiniciar ALUNBRIG a la misma dosis luego de la resolución de la bradicardia sintomática; de lo contrario, reducir la dosis de ALUNBRIG luego de la resolución de la bradicardia sintomática. Discontinuar ALUNBRIG para bradicardia fatal si no se identifica ningún medicamento concomitante que contribuya.
Molestias visuales: En ALTA, las reacciones adversas que llevan a molestias visuales, incluidas visión borrosa, diplopia y agudeza visual reducida, fueron informadas en 7,3% de los pacientes tratados con ALUNBRIG en el grupo de 90 mg y 10% de pacientes en el grupo de 90→180 mg. El edema macular Grado 3 y la catarata ocurrieron en un paciente en el grupo de 90→180 mg. Aconsejar a los pacientes que informan algún síntoma visual. Suspender ALUNBRIG y obtener una evaluación oftalmológica en pacientes con síntomas visuales nuevos o empeoramiento de Grado 2 o mayor severidad. Al recuperarse de las molestias visuales de Grado 2 o Grado 3 a severidad de Grado 1 o nivel basal, reiniciar ALUNBRIG a una dosis reducida. Discontinuar permanentemente el tratamiento con ALUNBRIG para molestias visuales de Grado 4.
Aumento de la creatina fosfoquinasa (CPK): En ALTA, el aumento de la creatina fosfoquinasa (CPK) ocurrió en 27% de los pacientes que recibieron ALUNBRIG en el grupo de 90 mg y 48% de los pacientes en el grupo de 90 mg→180 mg. La incidencia del aumento de CPK de Grado 3‑4 fue de 2,8% en el grupo de 90 mg y 12% en el grupo de 90→180 mg. La reducción de la dosis para el aumento de CPK ocurrió en 1,8% de los pacientes en el grupo de 90 mg y 4,5% en el grupo de 90→180 mg. Aconsejar a los pacientes que informen cualquier dolor muscular, flojedad o debilidad inexplicables. Monitorear los niveles de CPK durante el tratamiento con ALUNBRIG. Suspender ALUNBRIG para aumento de CPK de Grado 3 o 4. Al resolverse o recuperarse a Grado 1 o nivel basal, reiniciar ALUNBRIG a la misma dosis o a una dosis reducida.
Aumento de las enzimas pancreáticas: En ALTA, el aumento de amilasa ocurrió en 27% de los pacientes en el grupo de 90 mg y 39% de los pacientes en el grupo de 90→180 mg. Los aumentos de lipasa ocurrieron en 21% de los pacientes en el grupo de 90 mg y 45% de los pacientes en el grupo de 90→180 mg. El aumento de amilasa de Grado 3 o 4 ocurrió en 3,7% de los pacientes en el grupo de 90 mg y 2,7% de los pacientes en el grupo de 90→180 mg. El aumento de lipasa de Grado 3 o 4 ocurrió en 4,6% de los pacientes en el grupo de 90 mg y 5,5% de los pacientes en el grupo de 90→180 mg. Monitorear la lipasa y la amilasa durante el tratamiento con ALUNBRIG. Suspender ALUNBRIG para aumento de enzimas pancreáticas de Grado 3 o 4. Al resolver o recuperarse a Grado 1 o nivel basal, reiniciar ALUNBRIG a la misma dosis o a una dosis reducida.
Hiperglucemia: En ALTA, 43% de los pacientes que recibieron ALUNBRIG experimentaron empeoramiento o aparición de hiperglucemia. La hiperglucemia de Grado 3, basada en la evaluación de laboratorio de niveles de glucosa sérica en ayunas, ocurrieron en 3,7% de los pacientes. Dos de los 20 (10%) pacientes con diabetes o intolerancia a la glucosa a nivel basal requirieron iniciación con insulina mientras recibían ALUNBRIG. Evaluar la glucosa sérica en ayunas antes de iniciar ALUNBRIG y monitorear periódicamente de allí en más. Iniciar los medicamentos antihiperglucemiantes, si es necesario. Si no se puede lograr un control hiperglucémico adecuado con manejo médico óptimo, suspender ALUNBRIG hasta alcanzar el control hiperglucémico adecuado y considerar reducir la dosis de ALUNBRIG o discontinuar ALUNBRIG de manera permanente.
Toxicidad embrio-fetal: Basándose en su mecanismo de acción y hallazgos en animales, ALUNBRIG puede causar daño fetal cuando se administra a mujeres embarazadas. No existen datos clínicos acerca del uso de ALUNBRIG en mujeres embarazadas. Informar a las mujeres embarazadas acerca del riesgo potencial para el feto. Informar a las mujeres con potencial reproductivo que usen anticoncepción efectiva no hormonal durante el tratamiento con ALUNBRIG y durante al menos 4 meses luego de la dosis final. Informar a los hombres con parejas mujeres con potencial reproductivo que utilicen anticoncepción efectiva durante el tratamiento y al menos 3 meses después de la última dosis de ALUNBRIG.
REACCIONES ADVERSAS
Se produjeron reacciones adversas en 38% de los pacientes en el grupo de 90 mg y 40% de los pacientes en el grupo de 90→180 mg. Las reacciones adversas más comunes fueron neumonía (5,5% en total, 3,7% en el grupo de 90 mg, y 7,3% en el grupo de 90→180 mg) y ILD/neumonitis (4,6% en total, 1,8% en el grupo de 90 mg y 7,3% en el grupo de 90→180 mg). Ocurrieron reacciones adversas fatales en 3,7% de los pacientes y consistieron en neumonía (2 pacientes), muerte súbita, disnea, falla respiratoria, embolismo pulmonar, meningitis bacteriana y urosepsis (1 paciente cada una).
Las reacciones adversas más comunes (≥25%) en el grupo de 90 mg fueron náuseas (33%), fatiga (29%), cefalea (28%) y disnea (27%) y en el grupo de 90→180 mg fueron náuseas (40%), diarrea (38%), fatiga (36%), tos (34%) y cefalea (27%).
INTERACCIONES MEDICAMENTOSAS
Inhibidores de CYP3A: Evitar la coadministración de ALUNBRIG con inhibidores fuertes o moderados de CYP3A. Evitar el pomelo o su jugo ya que puede aumentar las concentraciones plasmáticas de brigatinib. Si no se puede evitar la administración de un inhibidor fuerte o moderado de CYP3A, reducir la dosis de ALUNBRIG.
Inductores de CYP3A: Evitar la coadministración de ALUNBRIG con inductores fuertes o moderados de CYP3A. Si no se puede evitar la administración de un inductor fuerte o moderado de CYP3A, reducir la dosis de ALUNBRIG.
Sustratos de CYP3A: La coadministración de ALUNBRIG con sustratos de CYP3A sensibles, incluidos los anticonceptivos hormonales puede dar como resultado concentraciones reducidas y pérdida de eficacia de los sustratos de CYP3A sensibles.
USO EN POBLACIONES ESPECÍFICAS
Embarazo: ALUNBRIG puede provocar daño fetal. Informar a las mujeres con potencial reproductivo acerca del riesgo potencial para el feto.
Lactancia: No existen datos respecto de la secreción de brigatinib a través de la leche humana o sus efectos sobre el lactante o la producción de leche. Debido a las reacciones adversas potenciales en los lactantes, informar a las madres que amamantan que no lo hagan durante el tratamiento con ALUNBRIG.
Potencial reproductivo en mujeres y varones:
Prueba de embarazo: Verificar el embarazo en mujeres con potencial reproductivo antes de iniciar ALUNBRIG.
Anticoncepción: Informar a las mujeres con potencial reproductivo que usen anticoncepción no hormonal efectiva durante el tratamiento con ALUNBRIG y durante al menos 4 meses después de la dosis final. Informar a los hombres con parejas mujeres con potencial reproductivo que utilicen anticoncepción efectiva durante el tratamiento con ALUNBRIG y durante al menos 3 meses después de la dosis final.
Infertilidad: ALUNBRIG puede causar reducción de la fertilidad en los hombres.
Uso pediátrico: La seguridad y la efectividad de ALUNBRIG en pacientes pediátricos no han sido establecidas.
Uso geriátrico: Los estudios clínicos de ALUNBRIG no incluyeron cantidades suficientes de pacientes de 65 años o mayores para determinar si respondieron de manera distinta a los pacientes más jóvenes.
Deterioro hepático o renal: No se recomienda ajustar la dosis en pacientes con deterioro hepático leve o moderado, o deterioro renal leve o moderado. Reducir la dosis de ALUNBRIG en pacientes con deterioro hepático severo o deterioro renal severo.
Consulte toda la Información de Prescripción en EE. UU. para ALUNBRIG en www.ALUNBRIG.com.
Acerca de Takeda Pharmaceutical Company Limited
Takeda Pharmaceutical Company Limited (TSE:4502/NYSE:TAK) es líder de la industria biofarmacéutica global, basado en valores, impulsado por la I&D, con sede central en Japón, comprometido con brindar una mejor salud y un futuro más brillante para los pacientes, al trasladar la ciencia a los medicamentos altamente innovadores. Takeda se centra en sus esfuerzos de I&D de cuatro áreas terapéuticas: Oncología, Gastroenterología (GI), Enfermedades Raras y Neurociencia. También realizamos inversiones que apuntan a la I&D en Terapias Derivadas del Plasma y Vacunas. Nos concentramos en desarrollar medicamentos altamente innovadores que contribuyen a hacer la diferencia en las vidas de las personas al cruzar la frontera de las nuevas opciones de tratamiento y al aprovechar nuestro motor de I&D colaborador mejorado y las capacidad de crear una red robusta de diversas modalidades. Nuestros empleados están comprometidos con la mejora de la calidad de vida de los pacientes y en trabajar con nuestros colaboradores en el cuidado de la salud en aproximadamente 80 países y regiones.
Para más información, visite https://www.takeda.com.
Aviso importante
A los fines de este anuncio, “comunicado de prensa” significa este documento, cualquier presentación oral, cualquier sesión de preguntas y respuestas y cualquier material escrito u oral debatido o distribuido por Takeda Pharmaceutical Company Limited (“Takeda”) respecto de este comunicado. Este comunicado de prensa (que incluye cualquier informe oral y cualquier pregunta y respuesta relacionada) no tiene la intención, ni constituye, ni representa, ni forma parte de ninguna oferta, invitación o solicitación de ninguna oferta de compra, o de adquisición, suscripción, intercambio, venta u otra enajenación de ningún título, ni la solicitación de ningún voto o aprobación en ninguna jurisdicción. No se ofrecen acciones ni ningún título al público, por medio de este comunicado de prensa. No se harán ofrecimientos de títulos en Estados Unidos excepto conforme al registro en la Ley de Títulos de EE. UU. de 1933, y sus enmiendas, o una excepción de ellas. Este comunicado de prensa se suministra (junto con otra información adicional que se pudiera suministrar al receptor) con la condición de que el receptor la use con fines informativos únicamente (y no para la evaluación de ninguna inversión, adquisición, enajenación o cualquier otra transacción). Cualquier incumplimiento de estas restricciones puede constituir una violación de las leyes de títulos aplicables.
Las compañías en las cuales Takeda directa e indirectamente posee inversiones son entidades separadas. En este comunicado de prensa, “Takeda” se utiliza a veces para conveniencia cuando se hacen referencias a Takeda y sus subsidiarias en general. De manera similar, las palabras “nosotros”, “a nosotros” y “nuestro/s” se usan también para referirse a subsidiarias en general o aquellas que trabajan para ellas. Estas expresiones también se usan donde no se sirve ningún propósito al identificar a la compañía o las compañías particulares.
Declaraciones anticipatorias
Este comunicado de prensa y cualquier material distribuido con relación a este comunicado de prensa pueden contener declaraciones anticipatorias, creencias u opiniones respecto del negocio futuro, la posición futura y los resultados de las operaciones de Takeda, incluidas estimaciones, pronósticos, objetivos y planes para Takeda. Sin limitación, las declaraciones anticipatorias a menudo incluyen palabras tales como “objetivos”, “planes”, “cree”, “espera”, “continúa”, “aguarda”, “apunta a”, “intenta”, “asegura”, “hará”, “puede”, “debe”, “haría”, “podría” “anticipa”, “estima”, “proyecta” o expresiones similares o la negativa de las mismas. Las declaraciones anticipatorias en este documento se basan en las estimaciones y las suposiciones de Takeda solamente a la fecha de este comunicado. Dichas declaraciones anticipatorias no representan ninguna garantía de parte de Takeda o su dirigencia de rendimiento futuro, ni involucran riesgos, incertidumbres y otros factores conocidos o desconocidos, incluidos, aunque sin limitación: las circunstancias económicas que rodean al negocio global de Takeda, incluidas las condiciones económicas generales en Japón y Estados Unidos; presiones competitivas y desarrollos; cambios a las leyes y regulaciones aplicables; el éxito o fracaso de los programas de desarrollo de productos; las decisiones de las autoridades regulatorias y la sincronización de las mismas; fluctuaciones en las tasas de interés y del tipo de cambio de divisas; afirmaciones o preocupaciones respecto de la seguridad o eficacia de los productos comercializados o los candidatos a producto; la sincronización e impacto de los esfuerzos de integración posteriores a una fusión con compañías adquiridas; y la capacidad para ceder activos que no son centrales para las operaciones de Takeda y la sincronización de dichas cesiones, cualquiera de las cuales pudiera hacer que los resultados, el rendimiento, los logros o la posición financiera reales de Takeda difieran materialmente de cualquier resultado, rendimiento, logro o posición financiera futuros expresados o implícitos en dichas declaraciones anticipatorias. Para más información sobre estos y otros factores que pudieran afectar los resultados, rendimiento, logros o posición financiera de Takeda, ver el “Ítem 3. Información Clave—D. Factores de Riesgo” en el Informe Anual más reciente de Takeda en el Formulario 20-F y otros informes de Takeda presentados ante la Comisión de Títulos y Valores de EE. UU., disponible en el sitio web de Takeda, https://www.takeda.com/investors/reports/sec-filings/, o en www.sec.gov. Los resultados, el rendimiento, los logros o la posición financiera de Takeda podrían diferir materialmente de los expresados o implícitos en las declaraciones anticipatorias. Las personas que reciben este comunicado de prensa no deben basarse indebidamente en ninguna declaración anticipatoria. Takeda no se compromete a tener obligación de actualizar ninguna de las declaraciones anticipatorias de este comunicado de prensa, ni ninguna otra declaración anticipatoria que pudiera hacer, excepto si la ley o normas de la bolsa de valores así lo dispone. El rendimiento del pasado no es un indicador de resultados futuros, y los resultados de Takeda en este comunicado de prensa pueden no ser indicativos, ni ser una estimación, un pronóstico o una proyección de resultados futuros de Takeda.
1 World Health Organization. Latest Global Cancer Data. https://www.who.int/cancer/PRGlobocanFinal.pdf. Consultado el 11 de mayo de 2019.
2 American Cancer Society. What is Non-Small Cell Lung Cancer? https://www.cancer.org/cancer/non-small-cell-lung-cancer/about/what-is-non-small-cell-lung-cancer.html. Consultado el 11 de mayo de 2019.
3 Kris MG, et al. JAMA, 2014;311:1998-2006.
4 Gainor JF, Varghese AM, Ou SH, et al. Clin Cancer Res. 2013;19(15):4273-81.
5 Koivunen JP, Mermel C, Zejnullahu K, et al. Clin Cancer Res. 2008; 14(13):4275-83.
6 Wong DW, Leung EL, So KK, et al. Cancer. 2009; 115(8):1723-33.
7 Chia PL, Mitchell P, Dobrovic A, John T. Clin Epidemiol, 2014;6:423-432.
El texto original en el idioma fuente de este comunicado es la versión oficial autorizada. Las traducciones solo se suministran como adaptación y deben cotejarse con el texto en el idioma fuente, que es la única versión del texto que tendrá un efecto legal.