DANVERS, Massachusetts, USA--(BUSINESS WIRE)--Wie zwei Studien an Patienten mit akutem Myokardinfarkt und kardiogenem Schock (AMICS) zeigen, ist die Überlebensrate beim Einsatz von Impella vor einer perkutanen koronaren Intervention (PCI) höher als bei einem Einsatz nach der PCI. Die Ergebnisse wurden auf der TCT Connect, dem 32. jährlichen Wissenschaftssymposium der Cardiovascular Research Foundation, präsentiert.
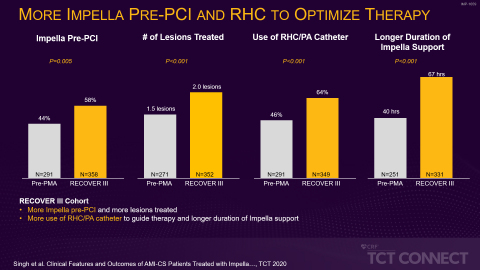
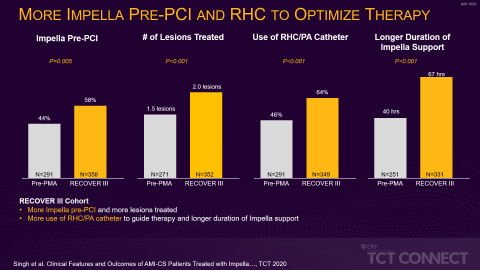
In der ersten Studie, die von Hemindermeet Singh, MD, vom Ascension St. John Hospital, vorgestellt wurde, verglichen die Forscher 649 Patienten aus zwei Kohorten: einer neueren Kohorte (2017 bis 2019) aus der Nachzulassungsstudie (Post-Market Approval, PMA) RECOVER III, als der Prä-PCI-Einsatz von Impella als Best Practise bereits weitgehend umgesetzt war, und einer Kohorte aus der Zeit vor der PMA (2008 bis 2014), als der Prä-PCI-Einsatz von Impella noch nicht weit verbreitet war. Die Forscher stellten in der jüngeren Kohorte eine relative Verbesserung des Gesamtüberlebens um 18 % fest. Das ist ein Anzeichen dafür, dass der Prä-PCI-Einsatz von Impella mit Vorteilen verbunden sein könnte. Die neuere Kohorte verzeichnete zudem eine geringere Inzidenz akuter Nierenverletzungen (AKI) und schwerer Blutungen oder vaskulärer Komplikationen bei Peri-PCI – und dies auch ungeachtet einer höheren Prävalenz von Bluthochdruck, Rauchen, Schlaganfall und Herzinsuffizienz Stadium III/IV nach NYHA (New York Heart Association) in der jüngeren Kohorte (siehe Abbildung 1).
„Diese Daten zeigen, dass die verstärkte Umsetzung der Best Practices für den kardiogenen Schock in den letzten drei Jahren zu einer Verbesserung des Gesamtüberlebens geführt hat“, so Amir Kaki, MD, Hauptautor der Studie, interventioneller Kardiologe und Director of Mechanical Circulatory Support am Ascension St. John Hospital. „Zur Verbesserung der Ergebnisse für unsere Patienten ist es wichtig, dass die Ärzte diese Best Practices anwenden: die frühzeitige Erkennung eines Schocks, die Verwendung eines Rechtsherzkatheters, die Reduzierung toxischer Inotropika und den Einsatz von Impella vor der PCI.“
„Unsere Studie spiegelt die wachsende Erfahrung von Ärzten und Einrichtungen wider. Die Einführung standardisierter Protokolle für den kardiogenen Schock und die zunehmende Anwendung von Strategien zur Senkung von Gefäß- und Blutungskomplikationen sind mit einer besseren Überlebensrate verbunden. Werden diese Faktoren umfassend verstanden, so könnte dies potenziell die Behandlungsergebnisse bei kardiogenem Schock für diese Patientengruppe erheblich verbessern“, fügt Dr. Singh an.
Die zweite Studie, die von Tayyab Shah, MD, Yale School of Medicine, vorgestellt wurde, analysierte die während der Studie RECOVER III zwischen 2017 und 2019 gesammelten Daten. Sie ergab, dass der Prä-PCI-Einsatz von Impella bei AMICS-Patienten mit einer höheren Überlebensrate assoziiert ist als der Post-PCI-Einsatz von Impella – dies gilt speziell für Frauen. Die Prüfärzte der Studie stellten fest, dass Frauen von einem relativen Überlebensvorteil von 74 % bei einem Prä-PCI-Einsatz gegenüber einem Post-PCI-Einsatz einer Impella profitierten. Die Autoren der Studie kommen zu dem Schluss, dass die frühzeitige Anwendung von Impella einen signifikanten Überlebensvorteil bietet, insbesondere bei Patientinnen (siehe Abbildung 2).
„Dem Ergebnis dieser Studie zufolge könnte ein frühzeitiger Einsatz von Impella zur Unterstützung von Patienten mit kardiogenem Schock vor der PCI und der Einsatz von Inotropika/Vasopressoren insbesondere Frauen einen Überlebensvorteil verschaffen“, berichtet Dr. Shah. „Dies ist ein interessantes Ergebnis einer Beobachtungsstudie mit aussagekräftigen klinischen Implikationen, die in der bevorstehenden randomisierten kontrollierten Studie RECOVER IV weiter untersucht werden müssen.“
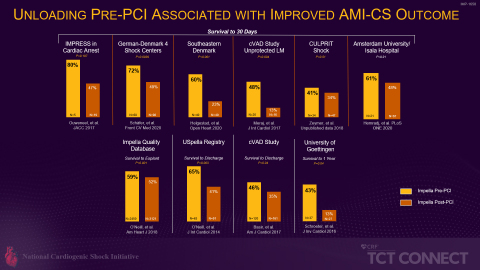
Seit der PMA-Zulassung durch die FDA hat Abiomed (NASDAQ: ABMD) Daten zu fast allen mit Impella behandelten Patienten aus den USA in der Beobachtungsdatenbank Impella Quality (IQ) gesammelt. Diese klinischen Daten, kombiniert mit den von der FDA nach der Zulassung durchgeführten Studien, wie z. B. RECOVER III, die in Abiomed‘s prospektive, vom IRB genehmigte cVAD-Studie (catheter-based Ventricular Assist Devices) eingebettet sind, trugen dazu bei, bewährte Verfahren für den Einsatz von Impella zu identifizieren und zu validieren, die mit einer verbesserten Überlebensrate und einer Erholung des nativen Herzens verbunden sind. Die Best Practices, wie der Prä-PCI-Einsatz von Impella, die Früherkennung eines Schocks, die Reduzierung von Inotropika und eine hämodynamische Überwachung mittels Pulmonalarterienkathetern, wurden inzwischen in zahlreichen Publikationen bewertet (siehe Abbildung 3).
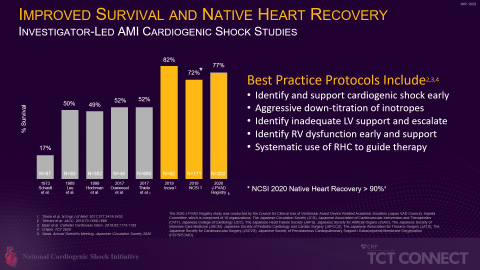
Darüber hinaus haben unabhängige Studien unter der Leitung von Ärzten mit Best-Practice-Protokollen, die einen Prä-PCI-Einsatz von Impella beinhalten, wie die Studie der National Cardiogenic Shock Initiative (NCSI), die Inova-Studie (Tehrani et al.) und die japanische P-VAD-Studie (J-PVAD), deutliche Steigerungen der Überlebensraten im Vergleich zu früheren Überlebensraten bei kardiogenem Schock gezeigt (siehe Abbildung 4). Diese Best Practices werden in das Studienprotokoll für die nächste randomisierte kontrollierte Studie RECOVER IV zu Impella an AMICS-Patienten einfließen.
Zum Austausch von Best Practices rund um die Behandlung kardiogener Schocks bei AMI richtet Abiomed am Sonntag, 18. Oktober 2020, um 10 Uhr EDT ein Symposium auf der TCT Connect mit dem Titel Achieving >70 % AMI-CS Survival: Best Practices from Around the World aus. Geleitet wird das Symposium von William O'Neill, MD, Medical Director des Center for Structural Heart Disease am Henry Ford Hospital.
ÜBER IMPELLA-HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung der US-amerikanischen Arzneimittelbehörde FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen erhalten, die sich einer elektiven und dringlichen perkutanen Koronarintervention (PCI), wie etwa einer Stentimplantation oder Ballonangioplastie, unterziehen, um verstopfte Koronararterien freizumachen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit SmartAssist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Die Impella RP® ist von der FDA zur Behandlung von Rechtsherzinsuffizienz oder -dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, einem Myokardinfarkt, einer Herztransplantation oder einer Operation am offenen Herzen zugelassen. Das Impella-RP-System darf außerdem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden rechtsventrikulären Unterstützung für die Dauer von bis zu 14 Tagen bei Intensivpatienten mit einer Körperoberfläche von ≥ 1,5 m2 zur Behandlung einer akuten Rechtsherzinsuffizienz oder Dekompensation aufgrund von Komplikationen im Zusammenhang mit der Coronavirus-Erkrankung 2019 (COVID-19), einschließlich Lungenembolie (PE), eingesetzt werden. Das Impella-RP-System ist nicht für die Behandlung einer akuten Rechtsherzinsuffizienz oder Dekompensation aufgrund von Komplikationen im Zusammenhang mit COVID-19 freigegeben oder zugelassen. Die Unterstützungssysteme von Impella für die linke Herzkammer (LV) dürfen zudem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden (≤ 4 Tage für Impella 2.5, Impella CP und Impella CP mit SmartAssist; und ≤ 14 Tage für Impella 5.0 und Impella 5.5 mit SmartAssist) LV-Entlastung und Unterstützung der Behandlung von Intensivpatienten mit bestätigter COVID-19-Infektion, die sich einer ECMO-Behandlung unterziehen und ein Lungenödem bei Unterstützung durch V-A-ECMO oder eine späte kardiale Dekompensation durch Myokarditis bei Unterstützung durch V-V ECMO entwickeln, eingesetzt werden. Die genehmigten Impella-LV-Unterstützungssysteme sind für einen Einsatz im Zusammenhang mit der genehmigten Indikation weder freigegeben noch zugelassen. Die Impella RP- und Impella LV-Unterstützungssysteme wurden von der FDA im Rahmen einer EUA für die oben genannte Notfallverwendung genehmigt und lediglich für die Dauer der Erklärung, dass Umstände vorliegen, die die Genehmigung der Notfallverwendung von Medizinprodukten nach Abschnitt 564(b)(1) des Gesetzes, 21 U.S.C. § 360bbb-3(b)(1) rechtfertigen, es sei denn, die Genehmigung wird früher aufgehoben oder widerrufen.
In Europa besitzen Impella 2.5, Impella CP und Impella CP mit SmartAssist die CE-Kennzeichnung für die Behandlung von Hochrisiko-PCI- und AMI-Patienten mit kardiogenem Schock für bis zu 5 Tage. Impella 5.0 und Impella LD besitzen die CE-Kennzeichnung für die Behandlung von Patienten mit Herzinfarkt oder Kardiomyopathie im kardiogenen Schock für bis zu 10 Tage. Impella 5.5 mit SmartAssist ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten im kardiogenen Schock bis zu 30 Tage lang zu behandeln. Impella RP ist CE-gekennzeichnet zur Behandlung von Rechtsherzinsuffizienz oder Dekompensation nach Implantation eines Linksherzunterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie. Weitere Informationen über die Impella-Plattform von Herzpumpen, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen im Zusammenhang mit der Verwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen durch eine Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Informationen finden Sie unter www.abiomed.com. Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA und bestimmten anderen Ländern eingetragen. Impella BTR, Impella ECP, CVAD Study und STEMI DTU Study sind angemeldete Marken von Abiomed, Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter auch in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, Fortschritte beim kommerziellen Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende behördliche Zulassungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unwägbarkeiten im Zusammenhang mit Umfang, Ausmaß und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung, Prüfung und damit verbundenen behördlichen Zulassungen, einschließlich der Möglichkeit künftiger Verluste, mit komplexer Herstellung, hohen Qualitätsanforderungen, Abhängigkeit von begrenzten Bezugsquellen, Wettbewerb, technologischen Veränderungen, staatlichen Auflagen, Rechtsstreitigkeiten, künftigem Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie anderen Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission (SEC) hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und der nachfolgend bei der SEC eingereichten Unterlagen, aufgeführt sind. Den Lesern dieser Pressemitteilung wird geraten, zukunftsgerichtete Aussagen, die ausschließlich den Informationsstand am Tag der Veröffentlichung widerspiegeln, nicht als verlässliche Informationen zu bewerten. Das Unternehmen ist nicht dazu verpflichtet, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch die Einwirkung unvorhersehbarer Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.