BASEL, Suíça e PEQUIM e CAMBRIDGE, Massachusetts--(BUSINESS WIRE)--BeiGene , Ltd. (NASDAQ: BGNE; HKEX: 06160; SSE: 688235), uma empresa internacional de oncologia, intensificou hoje sua expansão mundial contínua, rápido crescimento de receita a nível mundial e nos EUA, além de estratégia inovadora de P&D com apresentação dos resultados do quarto trimestre e de todo o ano de 2023 com destaques de negócios.
"A BeiGene obteve um grande progresso no quarto trimestre e em todo o ano de 2023 rumo à nossa meta de nos tornar um inovador oncológico impactante da próxima geração. Consolidamos nossa liderança em hematologia com o sucesso contínuo do lançamento mundial do BRUKINSA, liderado pelos EUA e Europa", disse John V. Oyler, Presidente, Cofundador e Diretor Executivo da BeiGene. "Nossa pesquisa, desenvolvimento e fabricação com vantagens de custo nos permitiram formar uma das maiores e mais interessantes linhas de produtos de oncologia do setor. Esperamos um ano transformador para a BeiGene, à medida que continuamos oferecendo excelência operacional, impulsionados por um excelente crescimento nas receitas em geografias novas e existentes."
Principais Destaques de Negócios e Linha de Produtos
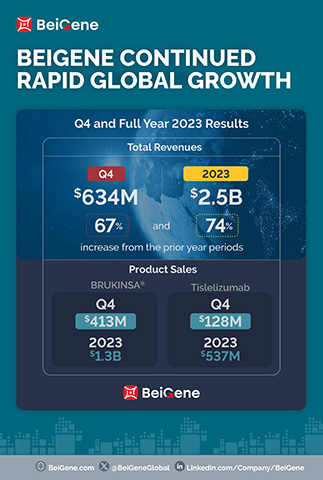
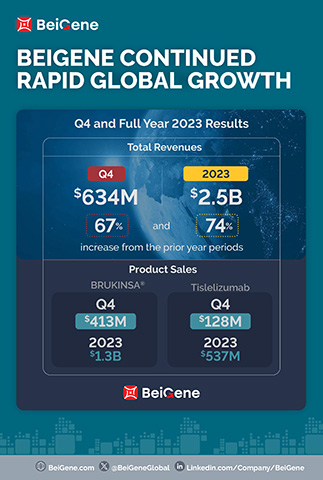
- As receitas de produtos no trimestre, US$ 630,5 milhões, e no ano inteiro, US$ 2,2 bilhões, aumentaram 86% e 75% quanto aos totais do ano anterior;
- A gestão disciplinada do crescimento das despesas operacionais levou a reduções em prejuízos operacionais de 18% e 33% em uma base GAAP e de 28% e 47% em uma base ajustada para o trimestre e o ano inteiro;
- Consolidou a posição do BRUKINSA como um inibidor de BTK de escolha com a aprovação da Food and Drug Administration (FDA) dos EUA ao atualizar o rótulo para incluir resultados superiores de sobrevida sem progressão (PFS) em um acompanhamento médio de 29,6 meses do ensaio ALPINE de fase 3, comparando o BRUKINSA e o IMBRUVICA ® (ibrutinibe) em pacientes previamente tratados com leucemia linfocítica crônica (LLC) reincidente ou refratária (R/R);
- Rótulo internacional expandido para BRUKINSA com aprovação da Comissão Europeia para tratamento de pacientes adultos com linfoma folicular (LF) R/R que receberam pelo menos dois tratamentos sistemáticos anteriores, que o torna o primeiro inibidor de BTK já aprovado nesta indicação e o inibidor de BTK com o rótulo mais amplo da classe;
-
Liderança demonstrada em hematologia e sólida linha de produtos da Empresa com 25 resumos apresentados no Encontro Anual da Sociedade Americana de Hematologia (ASH) em dezembro, incluindo:
- Resultados atualizados do estudo ALPINE demonstrando superioridade sustentada da PFS em um acompanhamento médio de 39 meses para o BRUKINSA em relação ao IMBRUVICA para tratar pacientes adultos com LLC R/R;
- Dados do ensaio de fase 1/2 para sonrotoclax demonstrando segurança e capacidade de tolerância em combinação com o BRUKINSA com respostas profundas e duradouras em LLC sem tratamento prévio; atividade promissora de agente único em pacientes com linfoma de zona marginal R/R; bem como eficácia e segurança promissoras em combinação com dexametasona no mieloma múltiplo (MM) com t(11,14); e
- Os primeiros dados em seres humanos para BTK CDAC BGB-16673 demonstram respostas clínicas notáveis e um perfil de segurança tolerável em pacientes intensamente pré-tratados com malignidades de células B, incluindo aqueles com doença resistente a BTKi.
- Expandiu o impacto mundial do anticorpo anti-PD-1 TEVIMBRA ® (tislelizumabe) com um parecer positivo do Comitê de Medicamentos para Uso Humano (CHMP) da Agência Europeia de Medicamentos (EMA) recomendando a aprovação como tratamento para câncer de pulmão com células não pequenas (NSCLC) em três indicações, aceitação pela EMA da submissão do tratamento de pacientes adultos com carcinoma espinocelular de esôfago (ESCC) de primeira linha, e revisões regulatórias em curso em 10 mercados, incluindo EUA e Europa; e
- Estratégia inovadora avançada de P&D ao inserir cinco Novas Entidades Moleculares (NEMs) na clínica em 2023, incluindo o potencial melhor inibidor de CDK4 da categoria, BGB-43395.
Destaques Financeiros do Quarto Trimestre e do Ano de 2023
As Receitas para o quarto trimestre e todo o ano de 2023 foram de US$ 634,4 milhões e US$ 2,5 bilhões, respectivamente, comparadas a US$ 380,1 milhões e US$ 1,4 bilhão nos períodos do ano anterior. O aumento na receita total no trimestre em comparação ao ano anterior é atribuído sobretudo ao crescimento das vendas de produtos nos principais mercados da Empresa. No quarto trimestre e no ano inteiro de 2023, os EUA foram o maior mercado do qual a empresa obteve receitas de US$ 313,2 milhões e US$ 1,1 bilhão, respectivamente, em comparação a US$ 155,4 milhões e US$ 502,6 milhões nos períodos do ano anterior. A Empresa espera que esta tendência prossiga em 2024, à medida que as vendas do BRUKINSA nos EUA continuam crescendo.
|
|
Três meses concluídos em 31 de dezembro de |
|
Doze meses concluídos em 31 de dezembro de |
||||||||
(em milhares, exceto valores por ação) |
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
Receita líquida de produtos |
|
$ |
630.526 |
|
$ |
339.022 |
|
$ |
2.189.852 |
|
$ |
1.254.612 |
Receita líquida de cooperações |
|
$ |
3.883 |
|
$ |
41.073 |
|
$ |
268.927 |
|
$ |
161.309 |
Receita total |
|
$ |
634.409 |
|
$ |
380.095 |
|
$ |
2.458.779 |
|
$ |
1.415.921 |
|
|
|
|
|
|
|
|
|
||||
Prejuízo de GAAP de operações |
|
$ |
(383.795) |
|
$ |
(468.622) |
|
$ |
(1.207.736) |
|
$ |
(1.789.665) |
Prejuízo ajustado de operações* |
|
$ |
(267.224) |
|
$ |
(372.480) |
|
$ |
(752.473) |
|
$ |
(1.420.225) |
|
|
|
|
|
|
|
|
|
||||
* Para obter uma explicação sobre nosso uso de medidas financeiras não-GAAP, consulte a seção "Uso de Medidas Financeiras Não-GAAP" posteriormente neste comunicado à imprensa, e para uma reconciliação de cada medida financeira não-GAAP com as medidas GAAP mais comparáveis, veja a tabela no fim deste comunicado. |
||||||||||||
As Receitas de Produtos totalizaram US$ 630,5 milhões e US$ 2,2 bilhões no quarto trimestre e no ano inteiro de 2023, respectivamente, em comparação a US$ 339,0 milhões e US$ 1,3 bilhão nos períodos do ano anterior, e incluem:
- Vendas mundiais do BRUKINSA de US$ 413,0 milhões e US$ 1,3 bilhão no quarto trimestre e no ano de 2023, respectivamente, comparadas a US$ 176,1 milhões e US$ 564,7 milhões nos períodos do ano anterior;
- Vendas de tislelizumabe de US$ 128,0 milhões e US$ 536,6 milhões no quarto trimestre e no ano inteiro de 2023, respectivamente, comparadas a US$ 102,2 milhões e US$ 422,9 milhões nos períodos do ano anterior;
- Vendas de produtos licenciados pela Amgen de US$ 51,1 milhões e US$ 188,3 milhões no quarto trimestre e no ano inteiro de 2023, respectivamente, comparadas a US$ 27,7 milhões e US$ 114,6 milhões nos períodos do ano anterior.
As Margens Brutas como porcentagem das vendas mundiais de produtos no quarto trimestre e no ano inteiro de 2023 foram de 83,2% e 82,7%, respectivamente, comparadas a 78,3% e 77,2% nos períodos do ano anterior. O percentual de margem bruta aumentou tanto no período trimestral quanto ano a ano devido a uma combinação de vendas de produtos proporcionalmente maior do BRUKINSA a nível mundial em comparação a outros produtos em nosso portfólio e a produtos licenciados com margem mais baixa, bem como custos mais baixos por unidade tanto para o BRUKINSA como para o tislelizumabe.
Despesas Operacionais
A seguinte tabela resume as despesas operacionais do quarto trimestre de 2023 e 2022, respectivamente:
|
|
GAAP |
|
|
|
Não-GAAP |
|
|
||||||||
(em milhares, exceto porcentagens) |
|
4ºT 2023 |
|
4ºT 2022 |
|
% Mudança |
|
4ºT 2023 |
|
4ºT 2022 |
|
% Mudança |
||||
Pesquisa e desenvolvimento |
|
$ |
493.987 |
|
$ |
446.023 |
|
11 % |
|
$ |
437.383 |
|
$ |
404.186 |
|
8% |
Vendas, gerais e administrativas |
|
$ |
416.547 |
|
$ |
328.984 |
|
27 % |
|
$ |
361.435 |
|
$ |
275.648 |
|
31% |
Amortização (1) |
|
$ |
1.838 |
|
$ |
188 |
|
878 % |
|
$ |
— |
|
$ |
— |
|
NM |
Despesas operacionais totais |
|
$ |
912.372 |
|
$ |
775.195 |
|
18 % |
|
$ |
798.818 |
|
$ |
679.834 |
|
18% |
A seguinte tabela resume as despesas operacionais do ano de 2023 e 2022, respectivamente:
|
|
GAAP |
|
|
|
Não-GAAP |
|
|
||||||||
(em milhares, exceto porcentagens) |
|
AF 2023 |
|
AF 2022 |
|
% Mudança |
|
AF 2023 |
|
AF 2022 |
|
% Mudança |
||||
Pesquisa e desenvolvimento |
|
$ |
1.778.594 |
|
$ |
1.640.508 |
|
8% |
|
$ |
1.558.960 |
|
$ |
1.474.919 |
|
6% |
Vendas, gerais e administrativas |
|
$ |
1.504.501 |
|
$ |
1.277.852 |
|
18% |
|
$ |
1.284.689 |
|
$ |
1.077.977 |
|
19% |
Amortização (1) |
|
$ |
3.500 |
|
$ |
751 |
|
366% |
|
$ |
— |
|
$ |
— |
|
NM |
Despesas operacionais totais |
|
$ |
3.286.595 |
|
$ |
2.919.111 |
|
13% |
|
$ |
2.843.649 |
|
$ |
2.552.896 |
|
11% |
(1) Refere-se ao ativo intangível de direitos de distribuição de produtos da BMS que foi totalmente amortizado em 31 de dezembro de 2023, quando os direitos foram revertidos à BMS nos termos do Acordo de Liquidação. |
||||||||||||||||
As Despesas com Pesquisa e Desenvolvimento (P&D) aumentaram no quarto trimestre e no ano inteiro de 2023 comparadas a períodos do ano anterior, tanto em uma base GAAP como ajustada, sobretudo devido ao investimento em novas plataformas / modalidades no avanço de programas pré-clínicos para clínicas e programas clínicos iniciais para o estágio final. As taxas iniciais referentes à pesquisa e desenvolvimento em processo para ativos licenciados totalizaram US$ 31,8 milhões e US$ 46,8 milhões no quarto trimestre e no ano inteiro de 2023, respectivamente, comparadas a US$ 48,7 milhões e US$ 68,7 milhões nos períodos do ano anterior.
As Despesas com Vendas, Gerais e Administrativas (SG&A) aumentaram no quarto trimestre e no ano inteiro de 2023 comparadas aos períodos do ano anterior, tanto em uma base GAAP como ajustada, devido ao investimento contínuo no lançamento comercial mundial do BRUKINSA, sobretudo nos EUA e Europa.
Prejuízo Líquido
O prejuízo líquido GAAP melhorou no quarto trimestre e no ano inteiro de 2023, comparado a períodos do ano anterior, atribuível sobretudo à redução de prejuízos operacionais e ao ganho não operacional de US$ 362,9 milhões referente ao acordo de arbitragem da BMS para todo o ano de 2023.
No quarto trimestre de 2023, o prejuízo líquido por ação foi de US$ 0,27 por ação e US$ 3,53 por ADS, comparado a US$ 0,33 por ação e US$ 4,29 por ADS no período do ano anterior. O prejuízo líquido para todo o ano de 2023 foi de US$ 0,65 por ação e US$ 8,45 por ADS, comparado a US$ 1,49 por ação e US$ 19,43 por ADS no período do ano anterior.
Caixa, equivalentes de caixa e caixa restrito |
||||
|
Ano concluído em 31 de dezembro de |
|||
|
|
2023 |
|
2022 |
|
(em milhares) |
|||
Caixa, equivalentes de caixa e caixa restrito no início do período |
$ |
3.875.037 |
$ |
4.382.887 |
Caixa líquido utilizado em atividades operacionais |
|
(1.157.453) |
|
(1.496.619) |
Caixa líquido fornecido por atividades de investimento |
|
60.004 |
|
1.077.123 |
Caixa líquido fornecido por (utilizado em) atividades de financiamento |
|
416.478 |
|
(18.971) |
Efeito líquido das mudanças nas taxas de câmbio |
|
(8.082) |
|
(69.383) |
Diminuição líquida em caixa, equivalentes de caixa e caixa restrito |
|
(689.053) |
|
(507.850) |
Caixa, equivalentes de caixa e caixa restrito no fim do período |
$ |
3.185.984 |
$ |
3.875.037 |
Valores Utilizados em Operações no quarto trimestre e no ano inteiro de 2023 foram de US$ 221,6 milhões e US$ 1,2 bilhão, respectivamente, comparados a US$ 318,2 milhões e US$ 1,5 bilhão nos períodos do ano anterior, impulsionado pela melhoria do aproveitamento operacional.
Para mais detalhes sobre Demonstrações Financeiras de 2023 da BeiGene, consulte o Relatório Anual da BeiGene no Formulário 10-K para o ano de 2023 apresentado à Comissão de Valores Mobiliários (SEC) dos EUA.
Programas de Progresso e Desenvolvimento Regulatório
Principais Destaques
- BRUKINSA consolidado como inibidor de BTK de escolha com atualização do rótulo de superioridade de PFS da FDA, aprovações em LF R/R na Europa e Canadá
- Alcance mundial expandido do TEVIMBRA com submissões regulatórias pendentes em 10 mercados, incluindo EUA e Europa
- Primeiros pacientes inscritos em um estudo mundial de fase 3 de sonrotoclax em LLC de primeira linha e grupos de expansão com potencial de registro para BTK CDAC
Categoria |
Produto |
Marcos recentes |
Aprovações regulatórias |
BRUKINSA |
|
TEVIMBRA |
|
|
Submissões regulatórias |
Tislelizumabe |
|
Atividades clínicas |
BRUKINSA |
|
Tislelizumabe |
|
|
Sonrotoclax
|
|
|
BTK CDAC
|
|
|
Anti-LAG3
|
|
|
Desenvolvimento antecipado
|
|
Próximos Marcos Previstos
Principais Destaques
- Garantir a aprovação da FDA para BRUKINSA em combinação com obinutuzumabe em R/R FL, que o torna inibidor de BTK com o rótulo mais amplo da classe
- Receber aprovação da FDA para tislelizumabe em ESCC de primeira e segunda linha, demonstrando a expansão mundial do portfólio inovador de tumores sólidos
Categoria |
Produto |
Marcos previstos |
Aprovações regulatórias antecipadas |
BRUKINSA |
|
Tislelizumabe |
|
|
Submissões regulatórias antecipadas |
BRUKINSA |
|
Tislelizumabe |
|
|
Zanidatamabe 2 |
|
|
Atividades clínicas antecipadas |
Sonrotoclax |
|
Ociperlimabe
|
|
|
Tarlatamabe 3
|
|
|
Desenvolvimento antecipado |
|
|
1 Liderança de cooperação da Biolabs; a BeiGene tem direitos comerciais excluindo a China |
||
2 Cooperação com a Jazz / Zymeworks; a BeiGene tem direitos comerciais na APAC (excluindo Japão), Austrália e Nova Zelândia |
||
3 Cooperação com Amgen; a BeiGene terá direitos comerciais na China e royalties escalonados de um dígito médio sobre vendas líquidas fora da China |
||
4 XmAb® é uma marca comercial registrada da Xencor, Inc. |
||
Operações de Produção
- Está quase concluída a principal instalação de fabricação de produtos biológicos e pesquisa e desenvolvimento clínicos de US$ 800 milhões no Princeton West Innovation Campus em Hopewell, Nova Jersey, que deverá estar operacional em julho de 2024; a propriedade possui mais de 1 milhão de pés quadrados de imóveis desenvolvíveis no total, permitindo expansão futura;
- Construção construída do novo campus de produção de pequenas moléculas em Suzhou, China. A fase 1 de construção acrescentou mais de 559.000 pés quadrados e expandiu a capacidade de produção para 1 bilhão de unidades de formas de dosagem sólidas ao ano; e
- Construção concluída de uma instalação de produção de ADC de 250.000 pés quadrados e capacidades adicionais de produção clínica de produtos biológicos de 170.000 pés quadrados em nossas instalações de produtos biológicos de última geração em Guangzhou, China, o que eleva a capacidade total para 65.000 litros.
Desenvolvimentos Corporativos
- Licença internacional exclusiva adquirida para um inibidor diferenciado de CDK2 da Ensem Therapeutics, Inc., complementando a linha de produtos de desenvolvimento inicial da empresa em câncer de mama e outros tumores sólidos.
Resumo Financeiro |
|||||
Seleção de Dados Condensados de Balanço Patrimonial Consolidado (US GAAP) |
|||||
(valores em milhares de dólares dos EUA) |
|||||
|
A partir de |
||||
|
31 de dezembro de |
|
31 de dezembro de |
||
|
|
2023 |
|
|
2022 |
|
(auditado) |
||||
Ativos: |
|
|
|
||
Caixa, equivalentes de caixa, caixa restrito e investimentos a curto prazo |
$ |
3.188.584 |
|
$ |
4.540.288 |
Contas a receber, líquidas |
|
358.027 |
|
|
173.168 |
Estoques, líquidos |
|
416.122 |
|
|
282.346 |
Imobilizado, líquido |
|
1.324.154 |
|
|
845.946 |
Total de ativos |
$ |
5.805.275 |
|
$ |
6.379.290 |
Passivos e patrimônio líquido: |
|
|
|
||
Contas a pagar |
$ |
315.111 |
|
$ |
294.781 |
Despesas acumuladas e outras contas a pagar |
|
693.731 |
|
|
467.352 |
Receita diferida |
|
300 |
|
|
255.887 |
Responsabilidade de participação nos custos de P&D |
|
238.666 |
|
|
293.960 |
Dívida |
|
885.984 |
|
|
538.117 |
Total de passivos |
|
2.267.948 |
|
|
1.995.935 |
Total de patrimônio líquido |
$ |
3.537.327 |
|
$ |
4.383.355 |
Demonstrações de Operações Consolidadas Condensadas (US GAAP) |
|||||||||||
(valores em milhares de dólares dos EUA, exceto ações, 'American Depositary Shares' (ADSs), por ação e por dados de ADS) |
|||||||||||
|
Três meses concluídos em 31 de dezembro de |
|
Dozes meses concluídos em 31 de dezembro de |
||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
(não auditado) |
|
(auditado) |
||||||||
Receita |
|
|
|
|
|
|
|
||||
Receita do produto, líquida |
$ |
630.526 |
|
$ |
339.022 |
|
$ |
2.189.852 |
|
$ |
1.254.612 |
Receita de cooperação |
|
3.883 |
|
|
41.073 |
|
|
268.927 |
|
|
161.309 |
Total de receitas |
|
634.409 |
|
|
380.095 |
|
|
2.458.779 |
|
|
1.415.921 |
Custo de vendas, produtos |
|
105.832 |
|
|
73.522 |
|
|
379.920 |
|
|
286.475 |
Lucro bruto |
|
528.577 |
|
|
306.573 |
|
|
2.078.859 |
|
|
1.129.446 |
Despesas operacionais |
|
|
|
|
|
|
|
||||
Pesquisa e desenvolvimento |
|
493.987 |
|
|
446.023 |
|
|
1.778.594 |
|
|
1.640.508 |
Vendas, gerais e administrativas |
|
416.547 |
|
|
328.984 |
|
|
1.504.501 |
|
|
1.277.852 |
Amortização de ativos intangíveis |
|
1.838 |
|
|
188 |
|
|
3.500 |
|
|
751 |
Total de despesas operacionais |
|
912.372 |
|
|
775.195 |
|
|
3.286.595 |
|
|
2.919.111 |
Prejuízo operacional |
|
(383.795) |
|
|
(468.622) |
|
|
(1.207.736) |
|
|
(1.789.665) |
Receita de juros, líquida |
|
16.274 |
|
|
18.219 |
|
|
74.009 |
|
|
52.480 |
Outras receitas (despesas), líquidas |
|
16.749 |
|
|
19.438 |
|
|
307.891 |
|
|
(223.852) |
Prejuízo antes do imposto de renda |
|
(350.772) |
|
|
(430.965) |
|
|
(825.836) |
|
|
(1.961.037) |
Despesa de imposto de renda |
|
16.781 |
|
|
14.370 |
|
|
55.872 |
|
|
42.778 |
Prejuízo líquido |
|
(367.553) |
|
|
(445.335) |
|
|
(881.708) |
|
|
(2.003.815) |
|
|
|
|
|
|
|
|
||||
Prejuízo líquido por ação |
$ |
(0,27) |
|
$ |
(0,33) |
|
$ |
(0,65) |
|
$ |
(1,49) |
Média ponderada de ações em circulação, básicas e diluídas |
|
1.353.005.058 |
|
|
1.348.916.108 |
|
|
1.357.034.547 |
|
|
1.340.729.572 |
|
|
|
|
|
|
|
|
||||
Prejuízo líquido por 'American Depositary Share' (ADS) |
$ |
(3,53) |
|
$ |
(4,29) |
|
$ |
(8,45) |
|
$ |
(19,43) |
Média ponderada de ADSs em circulação, básicas e diluídas |
|
104.077.312 |
|
|
103.762.778 |
|
|
104.387.273 |
|
|
103.133.044 |
Nota sobre o Uso de Medidas Financeiras não-GAAP
A BeiGene oferece certas medidas financeiras não-GAAP, incluindo despesas operacionais ajustadas e prejuízos operacionais ajustados e alguns outros itens de linha da demonstração de resultados não-GAAP, cada um dos quais inclui ajustes nos números GAAP. Estas medidas financeiras não-GAAP são pretendidas para fornecer informações adicionais sobre o desempenho operacional da BeiGene. Os ajustes nos números GAAP da BeiGene excluem, conforme aplicável, itens não monetários, como remuneração baseada em ações, depreciação e amortização. Certos outros itens especiais ou eventos substantivos também podem ser incluídos nos ajustes não-GAAP periodicamente quando sua magnitude for significativa dentro dos períodos incorridos. A BeiGene mantém uma política não-GAAP definida que orienta a determinação de quais custos serão excluídos em medidas financeiras não-GAAP, bem como os protocolos, controles e aprovações relacionados com relação ao uso de tais medidas. A BeiGene acredita que estas medidas financeiras não-GAAP, quando consideradas em conjunto com os números GAAP, podem melhorar uma compreensão geral do desempenho operacional da BeiGene. As medidas financeiras não-GAAP são incluídas visando fornecer aos investidores um entendimento mais completo dos resultados e tendências financeiras históricas e esperadas da Empresa, a fim de facilitar comparações entre períodos e referentes às informações projetadas. Além disto, estas medidas financeiras não-GAAP estão entre os indicadores que a administração da BeiGene utiliza para fins de planejamento e previsão e medir o desempenho da Empresa. Estas medidas financeiras não-GAAP devem ser consideradas adicionais, e não como um substituto ou superior às medidas financeiras calculadas segundo o GAAP. As medidas financeiras não-GAAP utilizadas pela Empresa podem ser calculadas de modo diferente e, assim, podem não ser comparáveis às medidas financeiras não-GAAP utilizadas por outras empresas.
RECONCILIAÇÃO DE MEDIDAS GAAP SELECIONADAS COM MEDIDAS NÃO-GAAP |
||||||||||||
(em milhares, exceto valores por ação) |
||||||||||||
(não auditado) |
||||||||||||
|
|
Três meses concluídos em 31 de dezembro de |
|
Doze meses concluídos em 31 de dezembro de |
||||||||
|
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
Reconciliação de GAAP com custo ajustado de vendas - produtos: |
|
|
|
|
|
|
|
|
||||
Custo de GAAP de vendas - produtos |
|
$ |
105.832 |
|
$ |
73.522 |
|
$ |
379.920 |
|
$ |
286.475 |
Menos: Depreciação |
|
|
1.898 |
|
|
— |
|
|
8.578 |
|
|
— |
Menos: Amortização de intangíveis |
|
|
1.119 |
|
|
781 |
|
|
3.739 |
|
|
3.225 |
Custo ajustado de vendas - produtos |
|
$ |
102.815 |
|
$ |
72.741 |
|
$ |
367.603 |
|
$ |
283.250 |
|
|
|
|
|
|
|
|
|
||||
Reconciliação de GAAP com pesquisa e desenvolvimento ajustados: |
|
|
|
|
|
|
|
|
||||
Pesquisa e desenvolvimento de GAAP |
|
$ |
493.987 |
|
$ |
446.023 |
|
$ |
1.778.594 |
|
$ |
1.640.508 |
Menos: Despesas de remuneração baseadas em ações |
|
|
39.424 |
|
|
34.966 |
|
|
163.550 |
|
|
139.348 |
Menos: Depreciação |
|
|
17.180 |
|
|
6.871 |
|
|
56.084 |
|
|
26.241 |
Pesquisa e desenvolvimento ajustados |
|
$ |
437.383 |
|
$ |
404.186 |
|
$ |
1.558.960 |
|
$ |
1.474.919 |
|
|
|
|
|
|
|
|
|
||||
Reconciliação de GAAP com vendas ajustadas, gerais e administrativas: |
|
|
|
|
|
|
|
|
||||
Vendas de GAAP, gerais e administrativas |
|
$ |
416.547 |
|
$ |
328.984 |
|
$ |
1.504.501 |
|
$ |
1.277.852 |
Menos: Despesas de remuneração baseadas em ações |
|
|
53.328 |
|
|
43.160 |
|
|
204.038 |
|
|
163.814 |
Menos: Depreciação |
|
|
1.784 |
|
|
10.176 |
|
|
15.774 |
|
|
36.061 |
Vendas ajustadas, gerais e administrativas |
|
$ |
361.435 |
|
$ |
275.648 |
|
$ |
1.284.689 |
|
$ |
1.077.977 |
|
|
|
|
|
|
|
|
|
||||
Reconciliação de GAAP com despesas operacionais ajustadas |
|
|
|
|
|
|
|
|
||||
Despesas operacionais de GAAP |
|
|
912.372 |
|
|
775.195 |
|
|
3.286.595 |
|
|
2.919.111 |
Menos: Despesas de remuneração baseadas em ações |
|
|
92.752 |
|
|
78.126 |
|
|
367.588 |
|
|
303.162 |
Menos: Depreciação |
|
|
18.964 |
|
|
17.047 |
|
|
71.858 |
|
|
62.302 |
Menos: Amortização de intangíveis |
|
|
1.838 |
|
|
188 |
|
|
3.500 |
|
|
751 |
Despesas operacionais ajustadas |
|
$ |
798.818 |
|
$ |
679.834 |
|
$ |
2.843.649 |
|
$ |
2.552.896 |
|
|
|
|
|
|
|
|
|
||||
Reconciliação do GAAP com prejuízo ajustado de operações: |
|
|
|
|
|
|
|
|
||||
Prejuízo de GAAP de operações |
|
$ |
(383.795) |
|
$ |
(468.622) |
|
$ |
(1.207.736) |
|
$ |
(1.789.665) |
Mais: Despesas de remuneração baseadas em ações |
|
|
92.752 |
|
|
78.126 |
|
|
367.588 |
|
|
303.162 |
Mais: Depreciação |
|
|
20.862 |
|
|
17.047 |
|
|
80.436 |
|
|
62.302 |
Mais: Amortização de intangíveis |
|
|
2.957 |
|
|
969 |
|
|
7.239 |
|
|
3.976 |
Prejuízo ajustado de operações |
|
$ |
(267.224) |
|
$ |
(372.480) |
|
$ |
(752.473) |
|
$ |
(1.420.225) |
|
|
|
|
|
|
|
|
|
||||
Observe que os valores apresentados acima podem não ter soma exata devido a arredondamentos
Sobre a BeiGene
A BeiGene é uma empresa internacional de oncologia que está descobrindo e desenvolvendo tratamentos inovadores mais acessíveis e razoáveis a pacientes com câncer ao redor do mundo. Com um amplo portfólio, estamos acelerando o desenvolvimento de nosso portfólio diversificado de novas terapias mediante nossas capacidades e cooperações internas. Estamos empenhados em melhorar radicalmente o acesso a medicamentos para muito mais pacientes que necessitam dos mesmos. Nossa crescente equipe mundial com mais de 10.000 colegas abrange cinco continentes, escritórios administrativos em Basel, Pequim e Cambridge, EUA. Para saber mais sobre a BeiGene, acesse www.beigene.com e siga-nos no LinkedIn e X (anteriormente conhecido como Twitter).
Declarações prospectivas
Este comunicado à imprensa contém declarações prospectivas conforme o significado da Lei de Reforma de Litígios de Valores Mobiliários Privados de 1995 e outras leis federais de valores mobiliários, incluindo declarações sobre o progresso da BeiGene de se tornar um inovador oncológico impactante de última geração; o futuro da linha de produtos de oncologia da BeiGene; a capacidade da BeiGene de aumentar a receita em geografias novas e existentes, sobretudo nos EUA; capacidades esperadas e datas de conclusão das instalações de fabricação da Empresa em construção e o potencial destas instalações de elevar as capacidades de produção; aprovações regulatórias, submissões e atividades clínicas antecipadas da BeiGene; e planos, compromissos, aspirações e metas da BeiGene sob o título "Sobre a BeiGene". Os resultados reais podem diferir materialmente daqueles indicados nas declarações prospectivas como resultado de diversos fatores importantes, incluindo a capacidade da BeiGene de demonstrar a eficácia e segurança de seus candidatos a medicamentos; resultados clínicos de seus candidatos a medicamentos, que podem não respaldar o desenvolvimento adicional ou aprovação de comercialização; ações de agências reguladoras, que podem afetar o início, o momento e o progresso dos ensaios clínicos e da aprovação de comercialização; a capacidade da BeiGene de obter sucesso comercial para seus medicamentos comercializados e candidatos a medicamentos, se aprovados; a capacidade da BeiGene de obter e manter a proteção da propriedade intelectual para seus medicamentos e tecnologia; a dependência da BeiGene de terceiros para conduzir o desenvolvimento, produção, comercialização de medicamentos e outros serviços; a experiência limitada da BeiGene em obter aprovações regulatórias e comercialização de produtos farmacêuticos; a capacidade da BeiGene de obter financiamento adicional para operações e concluir o desenvolvimento de seus candidatos a medicamentos, bem como alcançar e manter a rentabilidade; e estes riscos discutidos em mais detalhes na seção intitulada “Fatores de Risco” no relatório anual mais recente da BeiGene no Formulário 10-K, bem como discussões sobre riscos potenciais, incertezas e outros fatores importantes nos registros subsequentes da BeiGene junto à Comissão de Valores Mobiliários (SEC) dos EUA. Todas as informações neste comunicado à imprensa são válidas na data deste comunicado à imprensa, sendo que a BeiGene não assume nenhuma obrigação de atualizar tais informações, a menos que exigido por lei.
IMBRUVICA ® é uma marca comercial registrada da Pharmacyclics LLC.
O texto no idioma original deste anúncio é a versão oficial autorizada. As traduções são fornecidas apenas como uma facilidade e devem se referir ao texto no idioma original, que é a única versão do texto que tem efeito legal.