BASILEA, Suiza y BEIJING y CAMBRIDGE, Massachusetts--(BUSINESS WIRE)--BeiGene , Ltd. (NASDAQ: BGNE; HKEX: 06160; SSE: 688235), una empresa global de oncología, reafirmó hoy su continua expansión a nivel mundial, el rápido crecimiento de sus ingresos en todo el mundo y en Estados Unidos y su innovadora estrategia de I+D con la presentación de los resultados del cuarto trimestre, de todo el año 2023 y de los aspectos más destacados del negocio.
“BeiGene hizo grandes progresos en el cuarto trimestre y en todo el año 2023 hacia nuestro objetivo de convertirnos en una empresa innovadora en el campo oncológico de última generación que genere impacto. Hemos consolidado nuestro liderazgo en hematología con el creciente éxito del lanzamiento mundial de BRUKINSA, liderado por Estados Unidos y Europa”, afirmó John V. Oyler, presidente, cofundador y director ejecutivo de BeiGene. “Nuestra ventajosa relación costo-beneficio en investigación, desarrollo y fabricación nos ha permitido construir uno de los mayores y más interesantes proyectos oncológicos de la industria. Esperamos un año transformador para BeiGene, mientras que continuamos con la excelencia operativa impulsada por un crecimiento excepcional de los ingresos en geografías nuevas y existentes.”
Principales actividades y cartera de productos
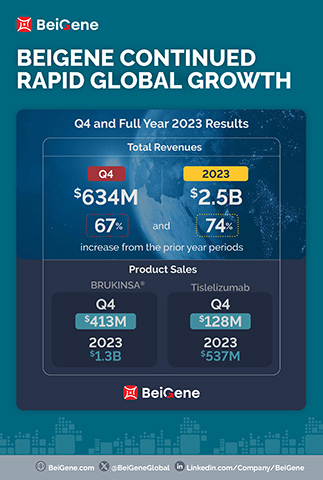
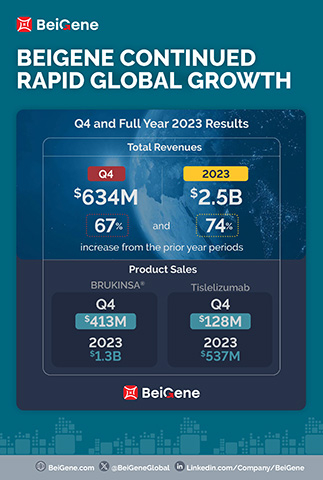
- Los ingresos por productos del trimestre, 630,5 millones de dólares y 2.200 millones de dólares de todo el año, aumentaron un 86 % y un 75 % respecto a los totales del año anterior;
- La gestión disciplinada del crecimiento de los gastos operativos impulsó una disminución de las pérdidas operativas del 18 % y del 33 %, según los principios GAAP y del 28 % y el 47 % según los principios ajustados para el trimestre y el año completo.
- Consolidación de la posición de BRUKINSA como inhibidor de elección de BTK con la aprobación por la Administración de Alimentos y Medicamentos (FDA) de EE. UU. de una actualización de la etiqueta para incluir resultados superiores de supervivencia sin progresión (SLP) en una mediana de seguimiento de 29,6 meses del ensayo de fase 3 ALPINE, en el que se compara BRUKINSA con IMBRUVICA® (ibrutinib) en pacientes con leucemia linfocítica crónica (LLC) recidivantes o refractaria (R/R) con tratamiento previo;
- Etiqueta mundial ampliada para BRUKINSA con la aprobación de la Comisión Europea para el tratamiento de pacientes adultos con linfoma folicular (LF) R/R que hayan recibido al menos dos tratamientos sistemáticos previos, lo que lo convierte en el primer inhibidor de BTK aprobado en esta indicación y en el inhibidor de BTK con la etiqueta más amplia de su clase.
-
Liderazgo probado en hematología y solidez de la cartera de productos de la empresa con la presentación de 25 reseñas en el Congreso Anual de la Sociedad Americana de Hematología (ASH) celebrado en diciembre, que incluían:
- Resultados actualizados del ensayo ALPINE que demuestran una superioridad sostenida de la SLP en una mediana de seguimiento de 39 meses para BRUKINSA en comparación con IMBRUVICA para el tratamiento de pacientes adultos con LLC recidivante;
- Datos de ensayos de fase 1/2 de sonrotoclax que demuestran seguridad y tolerabilidad en combinación con BRUKINSA con respuestas profundas y duraderas en pacientes con LLC sin tratamiento previo; prometedora actividad como agente único en pacientes con linfoma de zona marginal recidivante; y prometedora eficacia y seguridad en combinación con dexametasona en mieloma múltiple (MM) con t(11,14); y
- Primeros datos en humanos del BTK CDAC BGB-16673 que demuestran respuestas clínicas notables y un perfil de seguridad tolerable en pacientes con neoplasias de células B con varios tratamientos previos, incluidos aquellos con enfermedad resistente a BTKi.
- Ampliación del impacto mundial del anticuerpo anti-PD-1 TEVIMBRA ® (tislelizumab) con una opinión positiva del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) que recomienda su aprobación como tratamiento para el cáncer de pulmón no microcítico (CPNM) en tres indicaciones, aceptación de la EMA de la presentación para el tratamiento de pacientes adultos con carcinoma esofágico de células escamosas (ESCC) de primera línea, y revisiones regulatorias en curso en 10 mercados, incluidos EE. UU. y Europa; y
- Estrategia de I+D innovadora avanzada con la entrada en la clínica de cinco Nuevas Entidades Moleculares (NME) en 2023, incluido el potencial inhibidor de CDK4 BGB-43395, el mejor de su clase.
Datos financieros destacados del cuarto trimestre y el ejercicio 2023
Los ingresos del cuarto trimestre y de todo el ejercicio 2023 fueron de 634,4 millones de dólares y 2.500 millones de dólares, respectivamente, en comparación con los 380,1 millones de dólares y 1.400 millones de dólares en los periodos del año anterior. El aumento de los ingresos totales en el trimestre en comparación con el año anterior se atribuye principalmente al crecimiento de las ventas de productos en los principales mercados de la empresa. En el cuarto trimestre y en todo el año 2023, EE. UU. fue el mayor mercado para la empresa, con ingresos por 313,2 millones de dólares y 1.100 millones de dólares, respectivamente, frente a 155,4 millones de dólares y 502,6 millones de dólares en los periodos del año anterior. La empresa espera que esta tendencia se mantenga en 2024, a medida que sigan creciendo las ventas de BRUKINSA en Estados Unidos.
|
|
Trimestre finalizado el 31 de diciembre de |
|
Ejercicio finalizado el 31 de diciembre de |
||||||||
(expresado en miles, excepto los importes de acciones) |
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
Ingresos netos por productos |
|
$ |
630.526 |
|
$ |
339.022 |
|
$ |
2.189.852 |
|
$ |
1.254.612 |
Ingresos netos por colaboraciones |
|
$ |
3.883 |
|
$ |
41.073 |
|
$ |
268.927 |
|
$ |
161.309 |
Ingresos totales |
|
$ |
634.409 |
|
$ |
380.095 |
|
$ |
2.458.779 |
|
$ |
1.415.921 |
|
|
|
|
|
|
|
|
|
||||
Pérdida operativa según PCGA |
|
$ |
(383.795) |
|
$ |
(468.622) |
|
$ |
(1.207.736) |
|
$ |
(1.789.665) |
Pérdida operativa ajustada* |
|
$ |
(267.224) |
|
$ |
(372.480) |
|
$ |
(752.473) |
|
$ |
(1.420.225) |
|
|
|
|
|
|
|
|
|
||||
* Para una explicación de nuestro uso de medidas financieras que no se ajustan a los PCGA, consulte la sección "Uso de medidas financieras sin ajuste a los PCGA" más adelante en este comunicado de prensa y para una conciliación de cada medida financiera que no se ajusta a los PCGA con las medidas en virtud de los PCGA más comparables, consulte la tabla al final de este comunicado de prensa. |
||||||||||||
Los ingresos por ventas de productos ascendieron a 630,5 millones de dólares y 2.200 millones de dólares en el cuarto trimestre y en todo el año 2023, respectivamente, con respecto a los 339,0 millones de dólares y 1.300 millones de dólares en los periodos del año anterior, e incluyen:
- Ventas de BRUKINSA a nivel mundial por 413,0 millones de dólares y 1.300 millones de dólares en el cuarto trimestre y en todo el año 2023, respectivamente, en comparación con los 176,1 millones de dólares y 564,7 millones de dólares en los periodos del año anterior;
- Ventas de tislelizumab por 128,0 millones de dólares y 536,6 millones de dólares en el cuarto trimestre y en todo el año 2023, respectivamente, con respecto a los 102,2 millones de dólares y 422,9 millones de dólares en los periodos del año anterior;
- Las ventas de los productos bajo licencia de Amgen ascendieron a 51,1 millones de dólares y 188,3 millones de dólares en el cuarto trimestre y en todo el año 2023, respectivamente, respecto de los 27,7 millones de dólares y 114,6 millones de dólares en los periodos del año anterior.
El margen bruto como porcentaje de las ventas globales de productos en el cuarto trimestre y en todo el año 2023 fue del 83,2 % y del 82,7 %, respectivamente, en comparación con el 78,3 % y el 77,2 % de los periodos del año anterior. El porcentaje de margen bruto aumentó tanto en el período intertrimestral como en el interanual debido a una mezcla de ventas de productos proporcionalmente más alta de BRUKINSA a nivel mundial, en comparación con otros productos de nuestra cartera y productos con licencia con menos margen, así como menos costos por unidad tanto para BRUKINSA como para tislelizumab.
Gastos operativos
La siguiente tabla resume los gastos operativos para el cuarto trimestre de 2023 y 2022, respectivamente:
|
|
PCGA |
|
|
|
Sin ajuste por PCGA |
|
|
||||||||
(expresado en miles, excepto los porcentajes) |
|
T4 2023 |
|
T4 2022 |
|
% Change |
|
T4 2023 |
|
T4 2022 |
|
% Change |
||||
Investigación y desarrollo |
|
$ |
493.987 |
|
$ |
446.023 |
|
11 % |
|
$ |
437.383 |
|
$ |
404.186 |
|
8 % |
Gastos por ventas, generales y administrativos |
|
$ |
416.547 |
|
$ |
328.984 |
|
27 % |
|
$ |
361.435 |
|
$ |
275.648 |
|
31 % |
Amortización (1) |
|
$ |
1.838 |
|
$ |
188 |
|
878 % |
|
$ |
— |
|
$ |
— |
|
NM |
Total gatos operativos |
|
$ |
912.372 |
|
$ |
775.195 |
|
18 % |
|
$ |
798.818 |
|
$ |
679.834 |
|
18 % |
La siguiente tabla resume los gastos operativos de los ejercicios 2023 y 2022, respectivamente:
|
|
PCGA |
|
|
|
Sin ajuste por PCGA |
|
|
||||||||
(expresado en miles, excepto los porcentajes) |
|
EF 2023 |
|
EF 2022 |
|
% Change |
|
EF 2023 |
|
EF 2022 |
|
% Change |
||||
Investigación y desarrollo |
|
$ |
1.778.594 |
|
$ |
1.640.508 |
|
8 % |
|
$ |
1.558.960 |
|
$ |
1.474.919 |
|
6 % |
Gastos por ventas, generales y administrativos |
|
$ |
1.504.501 |
|
$ |
1.277.852 |
|
18 % |
|
$ |
1.284.689 |
|
$ |
1.077.977 |
|
19 % |
Amortización (1) |
|
$ |
3.500 |
|
$ |
751 |
|
366 % |
|
$ |
— |
|
$ |
— |
|
NM |
Total gastos operativos |
|
$ |
3.286.595 |
|
$ |
2.919.111 |
|
13 % |
|
$ |
2.843.649 |
|
$ |
2.552.896 |
|
11 % |
(1) Corresponde al activo no tangible sobre derechos de distribución de productos de BMS que se amortizó por completo al 31 de diciembre de 2023, cuando BMS recuperó los derechos, en virtud de los términos del Acuerdo de Conciliación. |
||||||||||||||||
Los gastos por Investigación y Desarrollo (I+D) aumentaron en el cuarto trimestre y en todo el año 2023 en comparación con los periodos del año anterior, tanto conforme a los PCGA o por ajuste, debido principalmente a la inversión en nuevas plataformas/modalidades para hacer avanzar los programas preclínicos hacia la clínica y los programas clínicos iniciales hacia la fase final. Las comisiones iniciales relacionadas con I+D en curso para activos bajo licencia ascendieron a 31,8 millones de dólares y 46,8 millones de dólares en el cuarto trimestre y en todo el año 2023, respectivamente, con respecto a los 48,7 millones de dólares y 68,7 millones de dólares en los periodos del año anterior.
Los gastos por ventas, generales y administrativos (SG&A) aumentaron en el cuarto trimestre y en todo el año 2023 en comparación con los periodos del año anterior, tanto en virtud de los PCGA y por ajuste, debido a la inversión continua en el lanzamiento comercial mundial de BRUKINSA, principalmente en EE. UU. y Europa.
Pérdida neta
La pérdida neta por PCGA mejoró en el cuarto trimestre y en todo el año 2023, en comparación con los periodos del año anterior, principalmente atribuible a la reducción de las pérdidas operativas y a la ganancia no operativa de 362,9 millones de dólares relacionada con el acuerdo de arbitraje con BMS para todo el año 2023.
En el cuarto trimestre de 2023, la pérdida neta por acción fue de 0,27 dólares por acción y 3,53 dólares por ADS, frente a los 0,33 dólares por acción y 4,29 dólares por ADS del periodo anterior. La pérdida neta en el ejercicio 2023 fue de 0,65 dólares por acción y 8,45 dólares por ADS, frente a los 1,49 dólares por acción y 19,43 dólares por ADS del ejercicio anterior.
Efectivo, equivalentes de efectivo y efectivo de disponibilidad restringida |
||||
|
Ejercicio finalizado el 31 de diciembre de |
|||
|
|
2023 |
|
2022 |
|
(expresado en miles) |
|||
Efectivo, equivalentes de efectivo y efectivo de disponibilidad restringida al inicio del período |
$ |
3.875.037 |
$ |
4.382.887 |
Efectivo neto utilizado en actividades operativas |
|
(1.157.453) |
|
(1.496.619) |
Efectivo neto procedente de actividades de inversión |
|
60.004 |
|
1.077.123 |
Efectivo neto procedente de (utilizado en ) actividades de financiación |
|
416.478 |
|
(18.971) |
Efectivo neto procedente de las variaciones en el tipo de cambio |
|
(8.082) |
|
(69.383) |
Disminución neta de efectivo, equivalentes de efectivo y efectivo de disponibilidad restringida |
|
(689.053) |
|
(507.850) |
Efectivo, equivalentes de efectivo y efectivo de disponibilidad restringida al final del período |
$ |
3.185.984 |
$ |
3.875.037 |
El efectivo utilizado en operaciones en el cuarto trimestre y en todo el año 2023 fue de 221,6 millones de dólares y 1.200 millones de dólares, respectivamente, en comparación con los 318,2 millones de dólares y 1.500 millones de dólares de los periodos del año anterior, impulsados por la mejora del apalancamiento operativo.
Para más detalles sobre los estados contables de BeiGene para 2023, consulte el Informe Anual de BeiGene en el Formulario 10-K para el año 2023 presentado ante la Comisión de Valores e Intercambio de los Estados Unidos.
Progreso regulatorio y programa de desarrollo
Aspectos destacados
- BRUKINSA se consolida como inhibidor de elección de BTK con la actualización de la etiqueta de superioridad de SLP de la FDA y las aprobaciones en FL R/R en Europa y Canadá.
- Ampliación del alcance mundial de TEVIMBRA con solicitudes de autorización pendientes en 10 mercados, incluidos EE. UU. y Europa.
- Inscripción de los primeros pacientes en un ensayo global de fase 3 para sonrotoclax en cohortes con LLC de primera línea y expansión con potencial de registro para BTK CDAC.
Categoría |
Activo |
Hitos recientes |
Autorizaciones regulatorias |
BRUKINSA |
|
TEVIMBRA |
|
|
Presentaciones regulatorias |
Tislelizumab |
|
Actividades clínicas |
BRUKINSA |
|
Tislelizumab |
|
|
Sonrotoclax
|
|
|
BTK CDAC
|
|
|
Anti-LAG3
|
|
|
Desarrollo temprano
|
|
Hitos previstos
Aspectos destacados
- Conseguir la aprobación de la FDA para BRUKINSA en combinación con obinutuzumab en FL R/R, convirtiéndolo en el inhibidor de BTK con la etiqueta más amplia de su clase.
- Aprobación de la FDA para el uso de tislelizumab en primera y segunda línea para el carcinoma espinocelular endotelial, lo que demuestra la expansión mundial de la innovadora cartera de productos para tumores sólidos.
Categoría |
Activo |
Hitos previstos |
Autorizaciones regulatorias previstas |
BRUKINSA |
|
Tislelizumab |
|
|
Presentaciones regulatorias previstas |
BRUKINSA |
|
Tislelizumab |
|
|
Zanidatamab 2 |
|
|
Actividades clínicas previstas |
Sonrotoclax |
|
Ociperlimab
|
|
|
Tarlatamab 3
|
|
|
Desarrollo temprano |
|
|
1 Dirige la colaboración con Biolabs; BeiGene tiene los derechos comerciales, sin incluir China. |
||
2 Colaboración con Jazz/Zymeworks; BeiGene tiene los derechos comerciales en APAC (sin incluir Japón), Australia, Nueva Zelanda. |
||
3 Colaboración con Amgen; BeiGene tiene los derechos comerciales en China y regalías escalonadas de un dígito sobre las ventas netas fuera de China. |
||
4 XmAb® es una marca registrada de Xencor, Inc. |
||
Operaciones de fabricación
- Casi finalizada la construcción de una planta de fabricación de productos biológicos e I+D clínica de 800 millones de dólares en el Princeton West Innovation Campus de Hopewell (Nueva Jersey), que se espera que entre en funcionamiento en julio de 2024; la propiedad cuenta con más de 1 millón de pies cuadrados de superficie urbanizable, lo que permite una futura expansión;
- Finalización de la construcción del nuevo campus de fabricación de moléculas pequeñas en Suzhou (China). La fase 1 de la construcción añadió más de 559.000 pies cuadrados y amplió la capacidad de producción a 1.000 millones de unidades de dosificación sólida al año; y
- Finalización de la construcción de una planta de producción de ADC de 250.000 metros cuadrados y de una planta adicional de producción clínica de biológicos de 170.000 pies cuadrados en nuestra moderna planta de biológicos de Guangzhou (China), lo que aumenta la capacidad total a 65.000 litros.
Evolución de la empresa
- Adquisición de una licencia mundial exclusiva para un inhibidor diferenciado de CDK2 de Ensem Therapeutics, Inc. que complementa la cartera de desarrollo temprano de la empresa en cáncer de mama y otros productos para tumores sólidos.
Resumen financiero |
|||||
Selección de datos resumidos del balance consolidado (PCGA de EE. UU.) |
|||||
(Montos expresados en miles de dólares estadounidenses) |
|||||
|
Al |
||||
|
31 de diciembre de |
|
31 de diciembre de |
||
|
|
2023 |
|
|
2022 |
|
(auditado) |
||||
Activo: |
|
|
|
||
Efectivo, equivalentes de efectivo, efectivo de disponibilidad restringida e inversiones a corto plazo |
$ |
3.188.584 |
|
$ |
4.540.288 |
Cuentas por cobrar, neto |
|
358.027 |
|
|
173.168 |
Inventario, neto |
|
416.122 |
|
|
282.346 |
Bienes de uso, neto |
|
1.324.154 |
|
|
845.946 |
Total Activo |
$ |
5.805.275 |
|
$ |
6.379.290 |
Pasivo y patrimonio neto |
|
|
|
||
Cuentas por pagas |
$ |
315.111 |
|
$ |
294.781 |
Gastos devengados y otras deudas |
|
693.731 |
|
|
467.352 |
Ingresos diferidos |
|
300 |
|
|
255.887 |
Participación de los costos de I+D |
|
238.666 |
|
|
293.960 |
Deudas |
|
885.984 |
|
|
538.117 |
Total Pasivo |
|
2.267.948 |
|
|
1.995.935 |
Total Patrimonio Neto |
$ |
3.537.327 |
|
$ |
4.383.355 |
Estado de resultados resumido y consolidado (PCGA de EE. UU.) |
|||||||||||
(Montos expresados en miles de dólares estadounidenses, excepto acciones, American Depositary Shares (ADS), por acción y por ADS) |
|||||||||||
|
Período de tres meses finalizado el 31 de diciembre de |
|
Período de doce meses finalizado el 31 de diciembre de |
||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
(sin auditar) |
|
(auditados) |
||||||||
Ganancias |
|
|
|
|
|
|
|
||||
Ingresos por productos, neto |
$ |
630.526 |
|
$ |
339.022 |
|
$ |
2.189.852 |
|
$ |
1.254.612 |
Ingresos por colaboraciones |
|
3.883 |
|
|
41.073 |
|
|
268.927 |
|
|
161.309 |
Total Ganancias |
|
634.409 |
|
|
380.095 |
|
|
2.458.779 |
|
|
1.415.921 |
Costo de ventas - productos |
|
105.832 |
|
|
73.522 |
|
|
379.920 |
|
|
286.475 |
Ganancia bruta |
|
528.577 |
|
|
306.573 |
|
|
2.078.859 |
|
|
1.129.446 |
Gastos operativos |
|
|
|
|
|
|
|
||||
Investigación y desarrollo |
|
493.987 |
|
|
446.023 |
|
|
1.778.594 |
|
|
1.640.508 |
Por ventas, generales y administrativos |
|
416.547 |
|
|
328.984 |
|
|
1.504.501 |
|
|
1.277.852 |
Amortización de activos intangibles |
|
1.838 |
|
|
188 |
|
|
3.500 |
|
|
751 |
Total gastos operativos |
|
912.372 |
|
|
775.195 |
|
|
3.286.595 |
|
|
2.919.111 |
Pérdida por operaciones |
|
(383.795) |
|
|
(468.622) |
|
|
(1.207.736) |
|
|
(1.789.665) |
Ingresos por intereses, neto |
|
16.274 |
|
|
18.219 |
|
|
74.009 |
|
|
52.480 |
Otros ingresos (gastos), neto |
|
16.749 |
|
|
19.438 |
|
|
307.891 |
|
|
(223.852) |
Pérdidas antes de impuestos |
|
(350.772) |
|
|
(430.965) |
|
|
(825.836) |
|
|
(1.961.037) |
Gastos por impuesto a las ganancias |
|
16.781 |
|
|
14.370 |
|
|
55.872 |
|
|
42.778 |
Pérdida neta |
|
(367.553) |
|
|
(445.335) |
|
|
(881.708) |
|
|
(2.003.815) |
|
|
|
|
|
|
|
|
||||
Pérdida neta por acción |
$ |
(0,27) |
|
$ |
(0,33) |
|
$ |
(0,65) |
|
$ |
(1,49) |
Promedio ponderado de acciones en circulación - básico y diluido |
|
1.353.005.058 |
|
|
1.348.916.108 |
|
|
1.357.034.547 |
|
|
1.340.729.572 |
|
|
|
|
|
|
|
|
||||
Pérdida neta por American Depositary Share (“ADS”) |
$ |
(3,53) |
|
$ |
(4,29) |
|
$ |
(8,45) |
|
$ |
(19,43) |
Promedio ponderado de ADS en circulación - básico y diluido |
|
104.077.312 |
|
|
103.762.778 |
|
|
104.387.273 |
|
|
103.133.044 |
Nota sobre el uso de medidas financieras no ajustadas a los PCGA
BeiGene proporciona ciertas medidas financieras sin ajuste por los PCGA, incluidos los Gastos Operativos Ajustados y las Pérdidas Operativas Ajustadas y otras partidas de la cuenta de resultados sin ajuste por los PCGA, cada una de las cuales incluye ajustes a las cifras de los PCGA. Estas medidas financieras sin ajuste por los PCGA pretenden proporcionar información adicional sobre el rendimiento operativo de BeiGene. Los ajustes a las cifras por los PCGA de BeiGene excluyen, según proceda, partidas no monetarias como la compensación basada en acciones, la depreciación y la amortización. También pueden incluirse periódicamente en los ajustes sin ajuste por los PCGA otras partidas especiales o hechos sustanciales cuando su magnitud sea significativa dentro de los periodos en que se produzcan. BeiGene mantiene una política establecida sin ajuste por los PCGA, que guía la determinación de qué costos se excluirán en estas medidas financieras y los protocolos, controles y aprobación relacionados con respecto al uso de tales medidas. BeiGene cree que estas medidas financieras, cuando se consideran junto con las cifras conforme a los PCGA, pueden mejorar la comprensión general del rendimiento operativo de BeiGene. Las medidas financieras sin ajuste por los PCGA se incluyen con la intención de proporcionar a los inversores una comprensión más completa de los resultados y tendencias financieros históricos y previstos de la empresa y para facilitar las comparaciones entre periodos y con respecto a la información proyectada. Además, estas medidas financieras que no se ajustan a los PCGA se encuentran entre los indicadores que la dirección de BeiGene utiliza con fines de planificación y previsión y para medir el rendimiento de la empresa. Estas medidas financieras deben considerarse además de, y no como sustituto o superior a, las medidas financieras calculadas de acuerdo con los PCGA. Las medidas financieras sin ajuste por los PCGA utilizadas por la empresa pueden calcularse de forma diferente y, por tanto, no ser comparables a las medidas financieras utilizadas por otras empresas.
CONCILIACIÓN DE MEDIDAS SELECCIÓN SEGÚN LOS PCGA CON RESPECTO A LAS MEDIDAS SIN AJUSTE A LOS PCGA |
||||||||||||
(expresados en miles, excepto por los montos de acciones) |
||||||||||||
(sin auditar) |
||||||||||||
|
|
Período de tres meses finalizado el 31 de diciembre de |
|
Período de doce meses finalizado el 31 de diciembre de |
||||||||
|
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
Conciliación de los PCGA para los costos de ventas- productos ajustados: |
|
|
|
|
|
|
|
|
||||
Costos de ventas - productos según PCGA |
|
$ |
105.832 |
|
$ |
73.522 |
|
$ |
379.920 |
|
$ |
286.475 |
Menos: amortización |
|
|
1.898 |
|
|
— |
|
|
8.578 |
|
|
— |
Menos: amortización de intangibles |
|
|
1.119 |
|
|
781 |
|
|
3.739 |
|
|
3.225 |
Costos de ventas- productos ajustados |
|
$ |
102.815 |
|
$ |
72.741 |
|
$ |
367.603 |
|
$ |
283.250 |
|
|
|
|
|
|
|
|
|
||||
Conciliación de PCGA para investigación y desarrollo ajustado: |
|
|
|
|
|
|
|
|
||||
Investigación y desarrollo por PCGA |
|
$ |
493.987 |
|
$ |
446.023 |
|
$ |
1.778.594 |
|
$ |
1.640.508 |
Menos: gastos de compensación compartidos |
|
|
39.424 |
|
|
34.966 |
|
|
163.550 |
|
|
139.348 |
menos: amortización |
|
|
17.180 |
|
|
6.871 |
|
|
56.084 |
|
|
26.241 |
Investigación y desarrollo ajustado |
|
$ |
437.383 |
|
$ |
404.186 |
|
$ |
1.558.960 |
|
$ |
1.474.919 |
|
|
|
|
|
|
|
|
|
||||
Conciliación de los PCGA frente a gastos por ventas, generales y administrativos: |
|
|
|
|
|
|
|
|
||||
Gastos por ventas, generales y administrativos por PCGA |
|
$ |
416.547 |
|
$ |
328.984 |
|
$ |
1.504.501 |
|
$ |
1.277.852 |
Menos: gastos de compensación compartidos |
|
|
53.328 |
|
|
43.160 |
|
|
204.038 |
|
|
163.814 |
Menos: amortización |
|
|
1.784 |
|
|
10.176 |
|
|
15.774 |
|
|
36.061 |
Gastos por ventas, generales y administrativos ajustados |
|
$ |
361.435 |
|
$ |
275.648 |
|
$ |
1.284.689 |
|
$ |
1.077.977 |
|
|
|
|
|
|
|
|
|
||||
Conciliación de los PCGA frente a gastos operativos ajustados |
|
|
|
|
|
|
|
|
||||
Gastos operativos por PCGA |
|
|
912.372 |
|
|
775.195 |
|
|
3.286.595 |
|
|
2.919.111 |
Menos: gastos de compensación compartidos |
|
|
92.752 |
|
|
78.126 |
|
|
367.588 |
|
|
303.162 |
Menos: amortización |
|
|
18.964 |
|
|
17.047 |
|
|
71.858 |
|
|
62.302 |
de intangibles |
|
|
1.838 |
|
|
188 |
|
|
3.500 |
|
|
751 |
Gastos operativos ajustados |
|
$ |
798.818 |
|
$ |
679.834 |
|
$ |
2.843.649 |
|
$ |
2.552.896 |
|
|
|
|
|
|
|
|
|
||||
Conciliación de los PCGA frente a pérdida ajustada procedente de las operaciones: |
|
|
|
|
|
|
|
|
||||
Pérdida procedente de las operaciones por PCGA |
|
$ |
(383.795) |
|
$ |
(468.622) |
|
$ |
(1.207.736) |
|
$ |
(1.789.665) |
Más: gastos de compensación compartidos |
|
|
92.752 |
|
|
78.126 |
|
|
367.588 |
|
|
303.162 |
Más: amortización |
|
|
20.862 |
|
|
17.047 |
|
|
80.436 |
|
|
62.302 |
Más: amortización de intangibles |
|
|
2.957 |
|
|
969 |
|
|
7.239 |
|
|
3.976 |
Pérdida ajustada procedente de las operaciones |
|
$ |
(267.224) |
|
$ |
(372.480) |
|
$ |
(752.473) |
|
$ |
(1.420.225) |
|
|
|
|
|
|
|
|
|
||||
Please note that the figures presented above may not sum exactly due to rounding
Acerca de BeiGene
BeiGene es una empresa mundial de oncología que descubre y desarrolla tratamientos innovadores más asequibles y accesibles para los pacientes de cáncer de todo el mundo. Con una amplia cartera de productos, estamos acelerando el desarrollo de nuestra variada cartera de productos terapéuticos novedosos a través de nuestras capacidades internas y colaboraciones. Nos hemos comprometido a mejorar radicalmente el acceso a los medicamentos para muchos más pacientes que los necesitan. Nuestro creciente equipo mundial de más de 10.000 colegas se extiende por los cinco continentes, con oficinas administrativas en Basilea, Pekín y Cambridge (EE. UU.). Para saber más sobre BeiGene, visitewww.beigene.com y síganos en and follow us on LinkedIn y X (anteriormente Twitter).
Declaraciones prospectivas
Este comunicado de prensa contiene declaraciones sobre previsiones en el sentido de la Ley de Reforma de Litigios sobre Valores Privados de 1995 (Private Securities Litigation Reform Act of 1995) y otras leyes federales sobre valores, incluidas declaraciones sobre el progreso de BeiGene para convertirse en un innovador oncológico de nueva generación de gran impacto; el futuro de la cartera de productos oncológicos de BeiGene; la capacidad de BeiGene para aumentar los ingresos en zonas geográficas nuevas y existentes, especialmente en EE.UU.; las capacidades previstas y las fechas de finalización de las instalaciones de fabricación en construcción de la empresa y la posibilidad de que dichas instalaciones aumenten las capacidades de fabricación; las aprobaciones reglamentarias, las presentaciones y las actividades clínicas previstas de BeiGene; y los planes, compromisos, aspiraciones y objetivos de BeiGene en el apartado "Acerca de BeiGene". Los resultados reales pueden diferir sustancialmente de los indicados en las declaraciones prospectivas como consecuencia de diversos factores importantes, como la capacidad de BeiGene para demostrar la eficacia y seguridad de sus medicamentos candidatos; los resultados clínicos de sus medicamentos candidatos, que pueden no respaldar el desarrollo ulterior o la aprobación de comercialización; las acciones de los organismos reguladores, que pueden afectar al inicio, calendario y progreso de los ensayos clínicos y la aprobación de comercialización; la capacidad de BeiGene para lograr el éxito comercial de sus medicamentos comercializados y medicamentos candidatos, si se aprueban; la capacidad de BeiGene para obtener y mantener la protección de la propiedad intelectual de sus medicamentos y tecnología; la dependencia de BeiGene de terceros para llevar a cabo el desarrollo, la fabricación, la comercialización y otros servicios de los medicamentos; la limitada experiencia de BeiGene en la obtención de aprobaciones reglamentarias y la comercialización de productos farmacéuticos; la capacidad de BeiGene para obtener financiación adicional para sus operaciones y para completar el desarrollo de sus medicamentos candidatos y lograr y mantener la rentabilidad; y los riesgos que se exponen con más detalle en la sección titulada "Factores de riesgo" del informe anual más reciente de BeiGene en el Formulario 10-K, así como los debates sobre posibles riesgos, incertidumbres y otros factores importantes en los documentos que BeiGene presentará posteriormente ante la U. S. Securities and Exchange Commission.Securities and Exchange Commission. Toda la información contenida en este comunicado de prensa se refiere a la fecha del mismo, y BeiGene no asume ninguna obligación de actualizar dicha información a menos que así lo exija la ley.
IMBRUVICA ®es una marca registrada de Pharmacyclics LLC.
El texto original en el idioma fuente de este comunicado es la versión oficial autorizada. Las traducciones solo se suministran como adaptación y deben cotejarse con el texto en el idioma fuente, que es la única versión del texto que tendrá un efecto legal.