FLAGSTAFF, Arizona (USA)--(BUSINESS WIRE)--W. L. Gore & Associates, Inc. (Gore) hat heute das erste Implantat der Thoracic Branch Endoprosthesis (TBE) GORE® TAG® im Rahmen der Schlüsselstudie bekannt gegeben. Der Patient wurde von Dr. med. Himanshu Patel, Abteilungsleiter Herzchirurgie für Erwachsene am Cardiovascular Center der University of Michigan und Co-Forschungsleiter auf nationaler Ebene, angemeldet.
Ziel der Studie ist es, die Sicherheit und Effizienz der TBE bei der Behandlung von Läsionen des Aortenbogens und des deszendierenden, intrathorakalen Teils der Aorta zu bestimmen, inklusive Dissektionen, Traumata und Aneurysmen. Diese Schlüsselstudie folgt auf eine erste Machbarkeitsstudie, die in den Zonen 0-1 mit dem Zweiggerät in der Kopf-Arm-Arterie (Brachiocephalic Artery, BCA) oder der linken Halsschlagader (Left Common Carotid, LCC) durchgeführt wurde, sowie auf eine Machbarkeitsstudie in Zone 2 mit dem Zweiggerät in der linken Schlüsselbeinschlagader (Left Subclavian Artery, LSA). Die Schlüsselstudie soll an bis zu 40 Standorten überall in den USA durchgeführt werden, an denen bis zu 435 Patienten angemeldet werden. Es sollen alle Ätiologien behandelt werden, bei denen die proximale Platzierung eines Grafts in den Zonen 0-2 erforderlich ist.
„Als kommerziell verfügbares Gerät wird die TBE neue, weniger invasive Behandlungsoptionen für Patienten mit Erkrankungen des Aortenbogens bieten, die bisher sowohl für offene chirurgische als auch endovaskuläre Behandlungen eine Herausforderung waren”, sagte Dr. Patel. „Die Anpassbarkeit des Geräts GORE® TAG® in Verbindung mit dem einzigartigen Nebenzweigdesign ermöglicht eine weniger invasive Behandlung des Aortenbogens mit Möglichkeiten für die Durchblutung der Kopf-Arm-Arterie, der linken Halsschlagader oder der linken Schlüsselbeinschlagader.”
Die Behandlung von Erkrankungen des Aortenbogens war schon immer schwierig. Die momentan für die Behandlung dieser Erkrankungen verfügbaren Optionen erfordern komplexe Verfahren wie offene Operationen, einen hybriden Ansatz mit operativer Revaskularisation oder kombinierte Verfahren, bei denen Geräte in zulassungsüberschreitender Kapazität eingesetzt werden. Die Begrenztheit der Optionen für diese Patienten ist einer der Gründe dafür, dass die TBE das erste Gerät von Gore ist, das die neue Kennzeichnung der FDA „Expedited Access Pathway” (EAP) erhält. Sie ist auch eines der ersten medizinischen Geräte in den USA, das diese Kennzeichung erhält. Diese Option ist auf bestimmte medizinische Geräte begrenzt, die das Potential aufweisen, ungedecktem medizinischem Bedarf für lebensbedrohliche Erkrankungen gerecht zu werden, und die im Vergleich zu bestehenden Alternativen bedeutende Vorteile für die Patienten bieten.
„Auf der Grundlage des Erfolgs der Machbarkeitsstudien und ersten Machbarkeitsstudien freuen wir uns sehr über diesen bedeutenden nächsten Schritt bei der Behandlung einer größeren Vielfalt von Patienten mit diesem innovativen Gerät”, sagte Dr. med. Michael Dake, von der Stanford University und Co-Forschungsleiter auf nationaler Ebene.
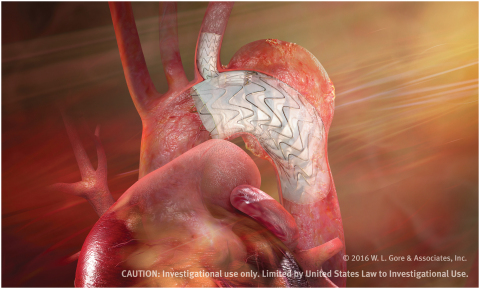
Die GORE TAG Thoracic Branch Endoprothese ist für langfristige Haltbarkeit konzipiert. Sie ist das erste serienmäßig hergestellte Gerät für die Aorta, das im Rahmen einer Schlüsselstudie untersucht wird. Es gibt sowohl eine Komponente für die Aorta als auch eine für einen Nebenzweig. Damit kann die Durchblutung für ein Bogengefäß ermöglicht werden. Das vorkanülierte Gerät wurde für die Minimierung des Risikos einer Blockierung des Zweiggefäßes und die Erleichterung der Implantierung konzipiert. Die Oberfläche der Zweigkomponente verfügt darüber hinaus über das CBAS-Heparin von Gore, die bewährte langlebige Heparin-Bindungstechnologie, die als Mittel gegen die Thrombusbildung entwickelt wurde.
„Die erste Implantation der TBE im Rahmen der Schlüsselstudie ist der neueste Schritt bei unseren laufenden Bemühungen, die umfassendsten auf dem Markt vorhandenen Möglichkeiten endovaskulärer Behandlungen anzubieten”, sagte Ryan Takeuchi, Aortic Business Leader bei Gore. „Nachdem wir bereits auf einige Pionierleistungen für diese Art von Geräten zurückblicken können, sind wir jetzt die ersten, die diese Art der Therapie in die Schlüsselphase bringen. So können anspruchsvolle Erkrankungen des Aortenbogens mit einem serienmäßig hergestellten endovaskulären Gerät behandelt werden.”
Die TBE ist Bestandteil der wachsenden Auswahl an endovaskulären Produkten, die alle dazu dienen, aortale Erkrankungen wirksam zu behandeln. Gestützt wird das Sortiment durch das hoch geschätzte klinische Supportteam und die umfassenden Ausbildungsangebote von Gore. Das umfangreiche Produktportfolio enthält das erste von der US-amerikanischen Arzneimittelzulassungsbehörde Food and Drug Administration (FDA) zugelassene serienmäßig produzierte Endoprothesensystem für Beckenarterien, das GORE® EXCLUDER® Iliac Branch Endoprosthesis (IBE), das zur endovaskulären Therapie von Aneurysmen der Arteria iliaca communis oder aortoiliakaler Aneurysmen indiziert ist. Zur Abrundung des breiten Portfolios laufen in den USA und Brasilien Studien zum Einsatz des thorakoabdominalen Zweiggeräts (Thoracoabdominal Branch Device, TAMBE) GORE® EXCLUDER®.
ÜBER W. L. GORE & ASSOCIATES
Bei Gore stellen wir seit 40 Jahren kreative therapeutische Lösungen für komplexe medizinische Probleme bereit. In diesem Zeitraum sind 40 Millionen innovative Medizinprodukte von Gore implantiert worden, die weltweit Leben gerettet und zu besserer Lebensqualität beigetragen haben. Unsere umfangreiche Produktreihe umfasst Gefäßprothesen, endovaskuläre und interventionelle Produkte, chirurgische Netze zur Behebung von Hernien und zur Weichteilrekonstruktion, Materialien zur Klammernahtverstärkung sowie Nähte für Gefäß-, Herz- und Allgemeinchirurgie. Wir gehören zu den wenigen Unternehmen, die auf allen US-amerikanischen Listen der „100 Best Companies to Work For” (die 100 beliebtesten Arbeitgeber) erschienen sind, seit die Bewertungen 1984 eingeführt wurden.
Die genannten Produkte sind eventuell nicht auf allen Märkten erhältlich.
CBAS ist ein Warenzeichen von Carmeda AB, einer hundertprozentigen Tochtergesellschaft von W. L. Gore & Associates, Inc.
GORE®, EXCLUDER®, TAG®, und die Designs sind Warenzeichen von W. L. Gore & Associates.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.