TORONTO--(BUSINESS WIRE)--Cynapsus Therapeutics Inc. (CTH : TSX-V) (CYNAF : OTCQX), une société pharmaceutique spécialisée ciblant la maladie de Parkinson, a annoncé aujourd’hui des résultats de haut niveau positifs de son essai clinique de phase II CTH-105 visant l’APL-130277 pour la gestion des symptômes moteurs lors de crises de Parkinson.
APL-130277 est une formulation d’apomorphine sous forme de pellicule sublinguale à action rapide. Les crises sont une complication de la maladie de Parkinson qui laisse les patients rigides et immobiles, incapables de bouger ou de communiquer. On estime qu’entre le quart et la moitié des personnes souffrant de la maladie de Parkinson dont les symptômes sont autrement gérés avec un traitement médicamenteux continu, subissent des crises au moins une fois par jour et jusqu’à six fois par jour, chaque crise durant de 30 à 120 minutes.
Les faits saillants des résultats de l’étude CTH-105 incluent :
- Des 16 patients traités par APL-130277, 14 sont passés de périodes avec crise à sans crise, suggérant que l’APL-130277 pourrait effectivement gérer les crises chez les patients souffrant de la maladie de Parkinson.
- Les données préliminaires indiquent que plusieurs sujets sont passés à des périodes sans crise avec une faible dose de 10 mg, tandis que 14 des 16 sujets sont passés à des périodes sans crise avec toutes les doses disponibles (c.-à-d. 10, 15, 20, 25 et 30 mg).
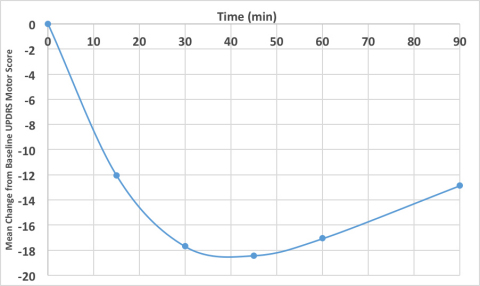
- Des améliorations cliniquement significatives de la coordination motrice sont survenues en aussi peu que 10 minutes après l’administration de l’APL-130277 pour une durée de plus de 90 minutes.
- La variation moyenne maximale par rapport à la référence sur l’échelle UPDRS III était de 18,4, un grand écart, cliniquement important.
- Le traitement par APL-130277 était sécuritaire et bien toléré, sans irritation locale ou hypotension posturale et avec une faible quantité d’événements de nausée.
« L’objectif de l’étude CTH-105 était de mieux comprendre la plage de doses de l’APL-130277 qui produit une efficacité, telle que mesurée par l’échelle UPDRS (Unified Parkinson's Disease Rating Scale), partie III, une échelle utilisée par les neurologues pour mesurer la sévérité des symptômes de crise et moteurs de la maladie de Parkinson, par rapport à la référence. Nous sommes heureux que l’APL-130277 ait fourni des avantages cliniques pour chacune des cinq doses visées par cette étude », Dr Albert Agro, directeur médical, Cynapsus. « Ces données préliminaires indiquent que l’APL-130277 était en mesure de faire passer des patients ayant des périodes de crise sévères le matin, à des périodes sans crise. De plus, le traitement était associé à une amélioration de 45 % de la fonction motrice selon l’échelle UPDRS, partie III, par rapport à la référence. La dose moyenne nécessaire pour arrêter les crises était de 18,4 mg. De plus, les patients qui ont présenté une réponse à des doses supérieures semblent s’adapter au traitement, ce qui est étayé par l’absence de nausées avec les fortes doses. »
Conception de l’étude de Phase II
Dans le cadre de l’étude multicentrique ouverte CTH-105, l’APL-130277 a été évalué chez 16 patients atteints de la maladie de Parkinson qui souffrent des effets invalidants de périodes de crise, crises d’une durée totale d’au moins deux heures par jour. À ce jour, 16 patients ont terminé le schéma posologique, ce qui était la taille prévue de l’échantillon de l’étude. En raison de la surinscription, trois patients supplémentaires reçoivent encore des doses. Les périodes de crise ont été déclenchées en demandant aux patients de prendre leur dernière dose de levodopa la nuit précédente, avant qu’ils ne se rendent en clinique. On a refusé aux patients leur première dose de levodopa le matin, entraînant une grave période de crise, du type parmi les plus difficiles à convertir et maintenir en période sans crise. Les patients ont ensuite reçu des doses croissantes d’APL-130277 (avec un minimum de trois heures entre les doses), jusqu’à ce qu’un état sans crise soit atteint, tel que documenté par le personnel de l’étude, le patient et une évaluation du clinicien selon l’échelle UPDRS, partie III. Le score de l’échelle UPDRS, partie III, était mesuré à 15, 30, 45, 60 et 90 minutes.
Résultats de l’étude de Phase II
Les cinq doses d’APL-130277 utilisées dans le cadre de l’étude (10, 15, 20, 25 et 30 mg) ont fait passer les patients d’une période de crise à une sans crise. La valeur de référence moyenne de l’échelle UPDRS, partie III, pour une période de crise était de 41,4, et la variation moyenne maximale par rapport à la référence de l’échelle UPDRS, partie III, était de 18,4. La dose moyenne nécessaire pour faire passer les patients à une période sans crise était de 18,4 mg. L’apparition d’une amélioration cliniquement significative se produisait en aussi peu que 10 minutes et durait pour une période allant jusqu’à 90 minutes, le dernier point horaire mesuré par l’étude. Le délai moyen jusqu’à une période sans crise, comme signalée par le personnel de l’étude, était de 22 minutes. Cynapsus croit que ces données étayent fortement la conclusion que l’APL-130277 est associé à une gestion robuste et rapide des périodes de crise.
Le graphique ci-dessous (cliquer le lien multimédia) illustre l'écart moyen, par rapport à l’indice de référence, de l’échelle UPDRS, partie III, pour les 14 sujets qui sont passés à une période sans crise. Deux patients ayant reçu la plus forte dose disponible (30 mg) n’ont pas atteint une période entièrement sans crise, comme évaluées par l’investigateur, suggérant que des doses plus élevées pourraient être nécessaires pour certains patients.
Le traitement par APL-130277 était sécuritaire et bien toléré. Des nausées ont été signalées par trois des sujets, à des doses de 10, 15 et 20 mg. Un de ces patients a également présenté un faible événement de vomissement. Aucune nausée n’a été signalée à des doses plus élevées. Il n’y a eu aucun rapport d’irritation locale ou d’hypotension chez les patients traités. Au total, 60 doses d’APL-130277 ont été administrées à 16 patients qui ont complété le dosage dans le cadre de l’étude CTH-105.
En fonction des constatations de cette étude, Cynapsus prévoit accomplir des études pivots d’une durée plus longue, et avec plus de patients pour confirmer ces résultats. Ces études pivots devraient faire partie du paquet d’inscription nécessaire pour une Demande de nouveau médicament 505(b)(2) auprès de la Food and Drug Administration américaine qui devrait être soumis en 2016.
« Les résultats de cet essai de Phase II sont importants, car les données indiquent que l’APL-130277 a fourni aux patients atteints de la maladie de Parkinson une amélioration rapide de la fonction motrice au cours des périodes de crise », explique Anthony Giovinazzo, président et directeur général de Cynapsus. « L’APL-130277 a été conçu pour répondre à un besoin significatif non répondu des personnes atteintes de la maladie de Parkinson aujourd’hui. Les résultats de l’essai CTH-105 continuent de nous laisser penser qu’APL-130277 pourrait aider la majorité des patients atteints de la maladie de Parkinson qui aurait besoin d’un rétablissement rapide du mouvement, sur demande, grâce à un type d’apomorphine, le seul médicament, et le plus efficace, approuvé à ces fins, facile à prendre et à administrer. »
« Les périodes de crise sont des événements invalidants pour les personnes atteintes de la maladie de Parkinson. Une enquête récente de The Michael J. Fox Foundation auprès de 3 000 patients atteints de la maladie de Parkinson ont révélé que près de la moitié ont dit que leurs périodes de crise modérées ou sévères font qu’ils doivent éviter ou interrompre leurs activités », explique Dr Todd Sherer, directeur général de The Michael J. Fox Foundation for Parkinson’s Research, qui a fourni 500 000 $ en financement pour l’étude. « Un traitement rapide et fiable en réponse aux périodes de crise pourrait être une importante avancée de traitement. Ces résultats suggèrent qu’APL-130277 pourraient offrir aux patients une qualité de vie accrue et, en tant que partisans de ce programme dès ses premiers jours, nous nous réjouissons à la perspective de poursuivre ce succès lors d’essais de phase III. »
À propos de la maladie de Parkinson et des périodes de crise
Plus de 1 million de personnes aux États-Unis et environ 4 à 6 millions de personnes du monde entier souffrent de la maladie de Parkinson. La maladie de Parkinson est une maladie neurodégénérative évolutive qui affecte l’activité motrice et sa prévalence augmente avec le vieillissement de la population. Les crises sont une complication de la maladie de Parkinson qui laisse les patients rigides et immobiles, incapables de bouger ou de communiquer. On estime qu’entre le quart et la moitié des personnes souffrant de la maladie de Parkinson dont les symptômes sont autrement gérés avec un traitement médicamenteux continu, subissent des crises au moins une fois par jour et jusqu’à six fois par jour, chaque crise durant de 30 à 120 minutes.
Les symptômes de crise et moteurs de la maladie de Parkinson sont mesurés sur l’échelle UPDRS, partie III. L’UPDRS est utilisé par les neurologues afin de mesurer la sévérité de la maladie de Parkinson.
À propos de l’apomorphine
L’apomorphine est le seul médicament qui peut rapidement faire passer un patient d’une période de crise (incapacité de bouger) à une période sans crise (complètement fonctionnel). Malheureusement, pour les patients atteints de la maladie de Parkinson, l’apomorphine est actuellement seulement offerte sous la forme d’une injection, qui peut être douloureuse et difficile à administrer, surtout en cours d’une période de crise.
Le médicament candidat de Cynapsus, l’APL-130277, est la seule formulation orale d’apomorphine pour le traitement de périodes de crise. L’APL-130277 est une pellicule qu’un patient souffrant de Parkinson peut placer sous sa langue au début d’une période de crise. Si approuvée, l’APL-130277 offrira aux patients une option pratique et facile aux multiples injections quotidiennes.
Téléconférence et diffusion Web
La direction de Cynapsus organisera une téléconférence accompagnée de diapositives afin de discuter de ces constatations et répondre aux questions aujourd’hui à 8 h, heure de l’Est. Les parties concernées et autres parties intéressées peuvent participer à l’appel en composant le 888 883-4599 (États-Unis) ou le 484 653-6821 et en signalant le numéro d’identification de la conférence 37666252. La téléconférence et les diapositives seront également diffusées en direct sur l’Internet, sur le site de la société auwww.cynapsus.ca, à la page Calendrier et Alertes dans la section Relations avec les investisseurs.
Une relecture de la téléconférence sera accessible deux heures après qu’elle soit terminée jusqu’au 26 novembre 2014 en composant le 855 859-2056 (États-Unis) ou 404 537-3406 (international) et en signalant le numéro d’identification de la conférence 37666252. La téléconférence et les diapositives seront également archivées 90 jours sur le site de la société au www.cynapsus.ca, à la page Calendrier et Alertes dans la section Relations avec les investisseurs.
À propos de Cynapsus Therapeutics
Cynapsus est une société pharmaceutique spécialisée qui développe une mince pellicule sublinguale pour le traitement d’urgence des symptômes moteurs des crises de Parkinson. Le médicament candidat de Cynapsus, l’APL-130277, est une formulation d’apomorphine facile à utiliser et à action rapide, l’un des seuls médicaments approuvés (aux États-Unis, en Europe, au Japon et dans d’autres pays).pour le traitement d’urgence des patients en période de crise. Cynapsus cible la maximalisation de la valeur d’APL-130277 en effectuant des études pivots à l’avance d’une demande de nouveau médicament (NDA) 505(b)(2) qui devrait être déposée en 2016.
De plus amples renseignements au sujet de Cynapsus peuvent être consultés sur www.cynapsus.caet le site de SEDAR au www.sedar.com.
Énoncés prospectifs
Ce communiqué contient des « énoncés prospectifs » au sens de la loi sur les valeurs mobilières. En règle générale ces énoncés prospectifs peuvent être identifiés par l’usage de formules de nature prospective comme « va », « projette », « prévoit » ou « n’attend pas », « devrait », « budgéter », « programmé », « estimations », « prévisions », « entend », « anticipe », « n’anticipe pas », « pense » ou de variantes de ces mots ou formules ou indiquant que des actions, événements ou résultats « peuvent », « pourraient », « seraient » ou « seront pris », « interviendront » ou « seront réalisés ». Les énoncés prospectifs sont soumis à des risques, incertitudes et autres facteurs connus et inconnus qui peuvent faire en sorte que les résultats, le niveau d’activité, la performance ou les accomplissements réels de Cynapsus sont sensiblement différents de ceux exprimés, explicitement ou implicitement, par de tels énoncés prospectifs, y compris, sans s’y limiter, les risques et incertitudes associés aux activités de Cynapsus divulguées sous la rubrique « Facteurs de risque » de sa Notice annuelle et ses autres soumissions auprès de divers organismes de régulation canadiens de valeurs mobilières, disponibles en ligne au www.sedar.com. Bien que Cynapsus se soit efforcée d’identifier les facteurs importants susceptibles d’entraîner des écarts notables entre les résultats effectifs et ceux contenus dans les énoncés prospectifs, d’autres facteurs peuvent intervenir et faire que les résultats s’écartent des prévisions, estimations ou objectifs. Aucune assurance ne peut être donnée quant à l’exactitude au final de ces énoncés dans la mesure où les résultats effectifs et les événements à venir peuvent s’avérer très différents de ceux anticipés dans ces énoncés. Les lecteurs sont invités par conséquent à ne pas prêter de confiance excessive aux énoncés prospectifs. Cynapsus décline toute obligation d’actualisation des énoncés prospectifs, sauf pour se conformer à la législation applicable en matière de valeurs mobilières.
Ni TSX Venture Exchange ni OTCQX International n’a approuvé ou désapprouvé le contenu de ce communiqué de presse.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.