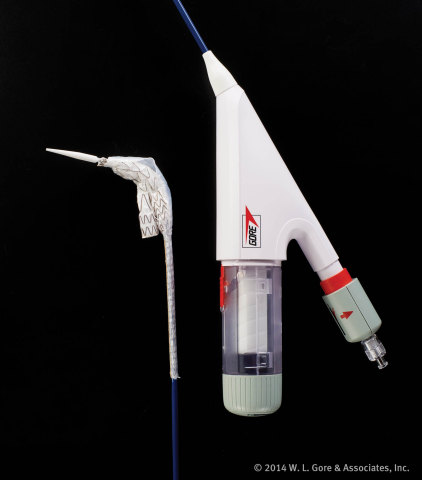
FLAGSTAFF, Arizona--(BUSINESS WIRE)--W. L. Gore & Associates, Inc. (Gore) a annoncé aujourd'hui que la Food and Drug Administration (FDA) avait autorisé l'initiation de l'étude clinique de la nouvelle endoprothèse AAA conformable GORE® EXCLUDER® et que la notification d'un essai clinique japonais pour le nouveau dispositif a été acceptée par l'Agence pour les produits pharmaceutiques et dispositifs médicaux du Japon (APPDM). Gore réalisera une étude clinique aux États-Unis et au Japon dans le but d'évaluer la sécurité et l'efficacité de l'endoprothèse AAA conformable GORE EXCLUDER dans le traitement des anévrysmes de l’aorte abdominale (AAA) infra rénaux chez des patients dont l'anatomie est problématique. Le nouveau dispositif est la prochaine génération de l'endoprothèse AAA GORE® EXCLUDER® et présente plusieurs caractéristiques de conception clés, y compris une conformabilité accrue et un système de pose avec contrôle de l'angulation.
Robert Rhee, MD, directeur du service de chirurgie vasculaire et endovasculaire au Maimonides Medical Center de New York, sera l'investigateur principal pour les États-Unis, et Takao Ohki MD, PhD, président et professeur au département de chirurgie de la Faculté de médecine de l'Université Jikei de Tokyo, sera l'investigateur principal pour le Japon.
« Les anatomies extrêmes du cou proximal sont l'une des principales raisons pour lesquelles un patient AAA ne serait pas candidat à un traitement endovasculaire », a déclaré le Dr. Ohki. « La nouvelle endoprothèse AAA conformable GORE EXCLUDER offrira une option de traitement mini-invasive pour les patients dans cette situation, dont certains ne peuvent pas subir une chirurgie ouverte. Ce dispositif peut constituer la seule option de traitement pour ces patients. »
L'essai clinique consiste en deux sous-études, évaluant chacune le dispositif pour différentes anatomies de patient. La première sous-étude évaluera le dispositif pour des angles de cou aortique proximal de zéro à 60 degrés et des longueurs de cou aortique de 10 mm ou plus. L'autre sous-étude évaluera des angles de cou aortique proximal de 61 à 90 degrés et des longueurs de cou aortique de 10 mm ou plus. Une fois autorisée, l'endoprothèse AAA conformable GORE EXCLUDER serait le seul dispositif indiqué pour des angles de cou aortique allant jusqu'a 90 degrés et des longueurs de cou aortique aussi courtes que 10 mm.
L'endoprothèse AAA conformable GORE EXCLUDER est déployée via un système de pose optimisé doté d'un contrôle de l'angulation permettant aux médecins d'incliner ou de courber le dispositif pour obtenir un placement orthogonal par rapport à la lumière d'écoulement de sang et maximiser la conformabilité du dispositif. Tout comme le système de pose GORE® C3®, le système de pose de l'endoprothèse AAA conformable GORE EXCLUDER permettra de repositionner le dispositif après son déploiement initial si nécessaire pour obtenir un placement optimal.
« Même si un dispositif est suffisamment flexible pour convenir à un cou aortique présentant une forte angulation, la conformabilité peut s'avérer difficile durant un déploiement avec les systèmes de pose actuels », a expliqué le Dr. Rhee. « Le système de pose conformable GORE EXCLUDER est conçu pour permettre aux médecins de mieux contrôler le placement du dispositif afin de maximiser sa conformabilité, indépendamment des défis anatomiques ».
L'endoprothèse AAA conformable GORE EXCLUDER met à profit la performance clinique éprouvée du dispositif AAA GORE EXCLUDER, avec ses 17 ans d'expérience à l'échelle mondiale et plus de 215 000 dispositifs distribués, des antécédents inégalés par les endoprothèses AAA disponibles à l'heure actuelle.
« Nous avons combiné une conception de stent novatrice, une conformabilité du dispositif, et un système de pose optimisé pour donner aux médecins encore plus de contrôle durant la procédure », a confié pour sa part Ryan Takeuchi, directeur de l'unité commerciale aortique chez Gore. « Nous considérons que cette combinaison est d'une importance critique pour augmenter efficacement la population traitable, en offrant les avantages d'un traitement endovasculaire à un plus grand nombre de patients. Nous sommes impatients d'initier cette étude clinique à la fois aux États-Unis et au Japon ».
Gore a atteint plusieurs autres jalons clés dans son engagement à fournir le portefeuille le plus complet de produits destinés à traiter durablement l'aorte. Plus récemment, le recrutement dans l'étude clinique de la branche iliaque GORE® EXCLUDER® a été complété et le premier patient a été recruté dans l'étude de faisabilité initiale de l'endoprothèse de branche thoracique GORE® TAG®, qui évaluera le traitement des anévrismes de la crosse aortique. En 2014, Gore a initié une étude clinique évaluant l'utilisation du même dispositif pour le traitement des anévrismes aortiques thoraciques nécessitant une couverture de l'artère sous-clavière gauche (LSG). Gore a également recruté son premier patient dans l'étude clinique des anévrismes aortiques thoraco-abdominaux Gore qui évaluera la réparation durable des anévrismes aortiques empiétant sur les rameaux viscéraux ou impliquant ces derniers, en utilisant l'endoprothèse de branche thoraco-abdominale GORE® EXCLUDER®.
À propos de W. L. Gore & Associates
Depuis plus de 35 ans, Gore fournit des solutions thérapeutiques novatrices pour des problèmes médicaux complexes. Au cours de cette période, plus de 35 millions de dispositifs médicaux novateurs de Gore ont été implantés, permettant ainsi de sauver de nombreuses vies et d’améliorer la qualité de vies dans le monde entier. Notre vaste gamme de produits comprend des greffons vasculaires, des dispositifs endovasculaires et interventionnels, des filets chirurgicaux pour le traitement des hernies et la reconstruction des tissus mous, des matériaux pour renforcer les rangées d’agrafes, et des sutures destinées à la chirurgie vasculaire, cardiaque et générale. Gore est l'une des quelques sociétés à figurer dans les listes américaines des « 100 meilleures entreprises pour lesquelles travailler », et ce depuis le début des classements en 1984. Pour de plus amples informations, veuillez consulter www.goremedical.com.
Il se peut que certains des produits listés ne soient pas disponibles sur tous les marchés. GORE®, C3®, EXCLUDER®, et TAG® sont des marques de commerce de W. L. Gore & Associates.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.