DANVERS, Massachusetts--(BUSINESS WIRE)--Die Restore EF-Studie zeigt, dass die Verwendung moderner Best-Practice-Methoden, einschließlich des Versuchs einer vollständigeren Revaskularisierung mittels Impella gestützter Hochrisiko-PCI, bei der Nachuntersuchung mit einer signifikanten Verbesserung der linksventrikulären Ejektionsfraktion (LVEF) sowie von Herzinsuffizienzsymptomen und pektanginösen Beschwerden einhergeht. Die Zwischenauswertung wurde heute von Mitul Patel, MD, einem interventionellen Kardiologen am UC San Diego Health im Rahmen von TCT Connect, dem 32. jährlichen wissenschaftlichen Symposium der Cardiovascular Research Foundation, vorgestellt.
Die laufende multizentrische, prospektive, einarmige Studie rekrutierte 193 konsekutiv qualifizierte Patienten, die sich zwischen September 2019 und September 2020 einer Protected-PCI mit Impella an 19 US-Krankenhäusern unterschiedlichen Typs unterzogen, darunter ländliche, städtische und kommunalen Einrichtungen sowie Universitätskliniken. Die Zwischenauswertung zeigte:
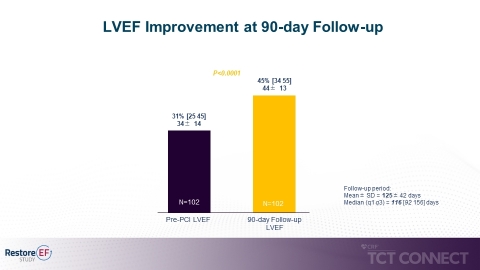
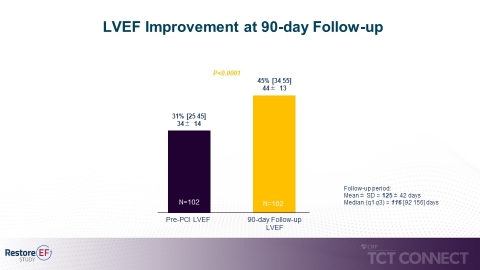
- Signifikante mediane LVEF-Verbesserung bei der Verlaufskontrolle nach 90 Tagen im Vergleich zur Ausgangslage (45% zu 31%, p<0,0001). Die LVEF-Verbesserung nach 90 Tagen ist der primäre Endpunkt der Studie. (siehe Abbildung 1)
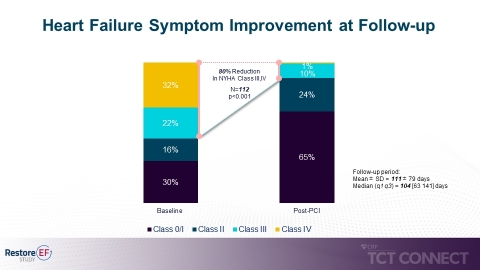
- Signifikante Reduzierung von Symptomen einer Herzinsuffizienz mit 80%iger Reduzierung bei NYHA-Klassifizierung III/IV (New York Heart Association) zum Zeitpunkt der Nachuntersuchung (54% auf 11%, p<0,001). (siehe Abbildung 2)
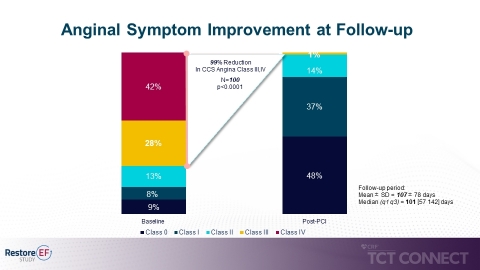
- Signifikante Reduzierung pektanginöser Symptome mit 99%iger Reduzierung bei CCS-Klassifizierung III/IV (Canadian Cardiovascular Society) zum Zeitpunkt der Nachuntersuchung (70% auf 1%, p<0,0001). (siehe Abbildung 3)
„Restore EF zeigt, dass Patienten nach Impella-gestützter PCI signifikante LVEF-Verbesserungen nach 90 Tagen aufwiesen. Die Studie fand auch eine signifikante Verbesserung der Herzinsuffizienzsymptome und pektanginösen Beschwerden, die mittels der funktionellen Klassifizierungssysteme der NYHA und CCS evaluiert wurden”, so Dr. Patel. „Insgesamt bestätigen diese Daten die Best-Practice-Methoden zur Behandlung von Hochrisiko-PCI-Patienten, zu denen auch die Verwendung von Impella zur vollständigen Revaskularisierung in einem einzigen Setting gehört.”
„Hochrisiko-PCI-Patienten stellen oftmals eine Herausforderung in Bezug auf die Revaskularisierung dar. Grund dafür sind Begleiterkrankungen der Patienten, eine eingeschränkte linksventrikuläre Funktion und ungünstige hämodynamische Verhältnisse, die schlechtere Ergebnisse wahrscheinlicher machen. Diese Untersuchung zeigt die Gründe für die Verwendung von Impella als Unterstützung bei einer Hochrisiko-PCI auf. Impella dient der Aufrechterhaltung der Koronarperfusion und der hämodynamischen Unterstützung in Phasen der Myokardischämie während langdauernder oder wiederholter Balloninsufflationen oder Atherektomien. Dies ermöglicht es den Ärzten, eine vollständige funktionelle Revaskularisierung und die bestmöglichen Ergebnisse für ihre Patienten zu erzielen”, so Jason Wollmuth, MD, interventioneller Kardiologe am Providence Health and Vascular Institute und Co-Principal Investigator der Restore EF Study.
Die Studie Restore EF ist Teil der Evidenzbasis, die belegt, dass Protected PCI und Impella mit Verbesserungen der LVEF und Herzinsuffizienzsymptomatik einhergehen. Zu diesen Studien gehören:
- Burzotta et al., die zeigten, dass die Therapie mittels Protected PCI mit Impella mit einer LVEV-Verbesserung nach 90 Tagen bei komplexen Hochrisiko-Patienten einherging (27% auf 33%, p<0,001). Die Autoren konstatierten zudem, dass eine vollständigere Revaskularisierung mit verbesserter LVEF und längerem Überleben assoziiert ist.
- Die randomisierte, kontrollierte Studie PROTECT II, die zeigte, dass Protected PCI mit Impella zu einer 58%igen Verbesserung bei NYHA-Herzinsuffzienzsymptomen der Klasse III und IV nach 90 Tagen führte (p<0,001). Die Studie fand zudem heraus, dass die Patienten im Rahmen der Nachbeobachtung nach einer Protected PCI mit Impella eine 22%ige LVEF-Verbesserung (p<0,001) zeigten.
- Maini et al., die eine 17%ige LVEV-Verbesserung bei der Nachuntersuchung nach Durchführung einer Protected PCI mit Impella (P<0,0001) zeigten.
Die Ergebnisse von Restore EF fließen in die Erstellung des Studienprotokolls der bevorstehenden randomisierten, kontrollierten Studie PROTECT IV ein. Bei PROTECT IV handelt es sich um eine prospektive, zweiarmige Studie, welche die vollständige Revaskularisierungs-PCI mit Impella mit einer Revaskularisierungs-PCI ohne geplante hämodynamische Unterstützung vergleicht. PROTECT IV ist Teil des klinischen Impella-Evidenzpfades, der zu einer klinischen Leitlinienempfehlung der Klasse I für Hochrisiko-PCI führen soll.
Die Studie Restore EF wird von Abiomed unterstützt und spiegelt das Bestreben des Unternehmens wider, in klinische Forschung zur Verbesserung der Behandlungserfolge bei Patienten zu investieren.
Zur Information über Best-Practice-Methoden bei Hochrisiko-PCI veranstaltet Abiomed ein Symposium im Rahmen von TCT Connect, am Samstag, dem 17. Oktober, um 14.00 Uhr EDT, unter dem Titel Protected PCI in COVID-19 Era: The Rise in Importance of Complete Revascularization (Protected PCI in Zeiten von COVID-19: Die Zunahme der Bedeutung der vollständigen Revaskularisierung). Das Symposium steht unter der Leitung von Cindy Grines, MD, Chief Scientific Officer am Northside Hospital Cardiovascular Institute in Atlanta und President of the Society for Cardiovascular Angiography and Interventions (SCAI). Es werden Best-Practice-Methoden für die Anwendung perkutaner mechanischer Kreislaufunterstützung zur Ermöglichung einer vollständigen Revaskularisierung bei Hochrisikopatienten erörtert.
ÜBER IMPELLA HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung der US-amerikanischen Arzneimittelbehörde FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen erhalten, die sich einer elektiven und dringlichen perkutanen Koronarintervention (PCI), wie etwa einer Stentimplantation oder Ballonangioplastie, unterziehen, um verstopfte Koronararterien freizumachen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit Smart Assist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Die Impella RP® ist von der FDA zur Behandlung von Rechtsherzinsuffizienz oder -dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, einem Myokardinfarkt, einer Herztransplantation oder einer Operation am offenen Herzen zugelassen. Das Impella-RP-System darf außerdem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden rechtsventrikulären Unterstützung für die Dauer von bis zu 14 Tagen bei Intensivpatienten mit einer Körperoberfläche von ≥ 1,5 m2 zur Behandlung einer akuten Rechtsherzinsuffizienz oder Dekompensation aufgrund von Komplikationen im Zusammenhang mit der Coronavirus-Erkrankung 2019 (COVID-19), einschließlich Lungenembolie (PE), eingesetzt werden. Das Impella-RP-System ist weder für die Behandlung der akuten Rechtsherzinsuffizienz noch für die Behandlung der Dekompensation aufgrund von Komplikationen im Zusammenhang mit COVID-19 freigegeben oder zugelassen. Die Unterstützungssysteme von Impella für die linke Herzkammer (LV) dürfen zudem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden (≤ 4 Tage für Impella 2.5, Impella CP und Impella CP mit SmartAssist; und ≤ 14 Tage für Impella 5.0 und Impella 5.5 mit SmartAssist) LV-Entlastung und Unterstützung der Behandlung von Intensivpatienten mit bestätigter COVID-19-Infektion, die sich einer ECMO-Behandlung unterziehen und ein Lungenödem bei Unterstützung durch V-A-ECMO oder eine späte kardiale Dekompensation durch Myokarditis bei Unterstützung durch V-V ECMO entwickeln, eingesetzt werden. Die genehmigten Impella-LV-Unterstützungssysteme sind für einen Einsatz im Zusammenhang mit der genehmigten Indikation weder freigegeben noch zugelassen. Die Impella RP und Impella LV Unterstützungssysteme wurden von der FDA im Rahmen einer EUA für einen oben bezeichneten Notfalleinsatz nur für die Dauer der Erklärung, dass Umstände vorliegen, die die Notfallgenehmigung medizinischer Geräte gemäß Abschnitt 564(b)(1) von Act. 21 U.S.C. § 360bbb-3(b)(1) begründen, zugelassen, es sei denn, die Zulassung wird früher beendet oder widerrufen.
In Europa besitzen Impella 2.5, Impella CP und Impella CP mit SmartAssist die CE-Kennzeichnung für die Behandlung von Hochrisiko-PCI- und AMI-Patienten mit kardiogenem Schock für bis zu 5 Tage. Impella 5.0 und Impella LD besitzen die CE-Kennzeichnung für die Behandlung von Patienten mit Herzinfarkt oder Kardiomyopathie im kardiogenen Schock für bis zu 10 Tage. Impella 5.5 mit SmartAssist ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten im kardiogenen Schock bis zu 30 Tage lang zu behandeln. Impella RP ist CE-gekennzeichnet zur Behandlung von Rechtsherzinsuffizienz oder Dekompensation nach Implantation eines Linksherzunterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie. Weitere Informationen über die Impella-Plattform von Herzpumpen, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen im Zusammenhang mit der Verwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Informationen finden Sie unter www.abiomed.com. Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA und bestimmten anderen Ländern eingetragen. Impella BTR, Impella ECP, CVAD Study und STEMI DTU Study sind angemeldete Marken von Abiomed, Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter auch in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, das kommerzielle Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende regulatorische Genehmigungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unwägbarkeiten im Zusammenhang mit Umfang, Ausmaß und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Genehmigungen, einschließlich der Möglichkeit künftiger Verluste, mit komplexer Herstellung, hohen Qualitätsanforderungen, Abhängigkeit von begrenzten Bezugsquellen, Wettbewerb, technologischen Veränderungen, staatlichen Auflagen, Rechtsstreitigkeiten, künftigem Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie anderen Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission (SEC) hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und der nachfolgend bei der SEC eingereichten Unterlagen, dargelegt werden. Den Lesern dieser Pressemitteilung wird geraten, zukunftsgerichtete Aussagen, die ausschließlich den Informationsstand am Tag der Veröffentlichung widerspiegeln, nicht als verlässliche Informationen zu bewerten. Das Unternehmen ist nicht dazu verpflichtet, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch die Einwirkung unvorhersehbarer Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.