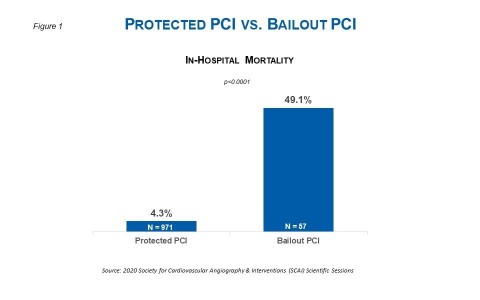
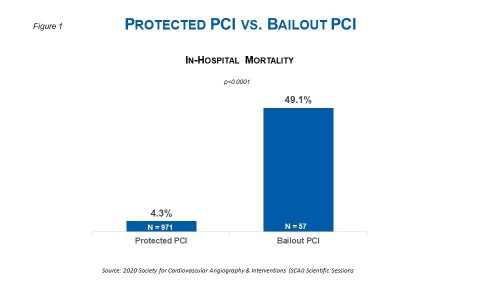
米マサチューセッツ州ダンバース--(BUSINESS WIRE)--(ビジネスワイヤ) -- 2020年米国心臓血管造影・インターベンション学会(SCAI)のオンラインセッションで発表された、1,000人以上の患者さんデータによると、緊急性のない経皮的冠動脈インターベンション(PCI)施行前にImpellaを留置した場合、院内死亡率が減少することが示されました。オンライン発表で詳述されているように、高リスクPCIの条件において、PCI施行前のImpella留置は、ベイルアウトPCI中のImpella留置と比較して、院内死亡率が10分の1に減少することが研究で明らかになりました(図1参照)。ベイルアウトPCIとは、医師がImpellaによるサポートをする予定がない、特定のまたは緊急のPCIを開始した後に患者の血行動態が不安定になった場合、手技中にImpellaのサポートを開始する症例、と定義されています。
今回発表されたデータは、高リスクPCIにおけるImpellaの使用について現在進行中の前向きFDA承認後研究である、PROTECT III試験に属する研究から得られたものです。この研究論文の著者は、ヘンリー・フォード病院、構造心臓病センターのメディカルディレクターのウィリアム・オニール医師(MD)と、コロンビア大学医療センター内科教授で同センターの心血管インターベンション・ディレクターのジェフリー・W・モーゼス医師(MD)です。
本論文の著者らは次のように述べています。「血行動態が安定していて非緊急のPCIを受ける患者におけるImpellaサポートは、Protected(プロテクテッド) PCIと呼ばれ、PCI施術中の血行動態破綻のリスクが高い特定の患者集団の治療として確立されています。しかし、一部の医師は、予防的な血行動態サポートを避け、血行動態破綻が生じれば救済的(ベイルアウト)な戦略を好んで選択する場合があります。本研究の目的は、そのような救済的戦略におけるリスクを定量化することです。」
本研究ではImpella 2.5またはImpella CPによるサポートを受けた患者1,028人(Protected PCI群971人、ベイルアウトPCI群57人)の分析が行われました。ベイルアウトPCI群では、女性の割合が高く(50.9%対27.2%、p=0.0002)、ベースラインにおける左室駆出率の中央値が有意に高く(40%対30%、p<0.0001)、心不全の割合が低く(42.1%対56.9%、p=0.039)、左主幹部病変の割合が低い(40.0%対56.1%、p=0.03)ものでした。即ち、ベイルアウトPCI群では女性の割合が高く、年齢が低く、左室駆出率が高く、心不全の割合が低くなっていました。これらの違いにかかわらず、本研究では下記の点が明らかになりました。
- 院内死亡率はベイルアウトPCI群の方がProtected PCI群と比較して有意に高かった(49.1%対4.3%、p<0.0001)。死亡率の差は、難治性低血圧または冠動脈穿孔/解離に伴う血行動態破綻を経験した患者において有意であった。
オニール医師は次のように述べています。「緊急性のないPCI中に血行動態破綻を経験する可能性がある患者の予見的識別ができなかった場合、院内死亡率を過度に上昇させることにつながります。本データは、PCI開始前にImpellaサポートをすることで、このリスクを低減できることを示しています。」
アトランタのノースサイド・ホスピタル心臓血管研究所の最高科学責任者(CSO)であるシンディ・グラインズ医師(MD)は、次のように述べています。「救済的なImpella留置を必要とする患者の多くは、左室駆出率が正常に近い若い女性で、機械的補助循環の対象として見落とされる場合が多くあります。しかし、これらの女性患者は、PCI中の長時間の虚血に耐えられない可能性があります。これらのデータは、女性患者を脆弱な集団と認識し、事前にサポートを検討する必要があることを示しています。」
「複雑な冠動脈疾患に対する最適な経皮的冠動脈インターベンション治療に関する2020年SCAIの提言」に詳述されていますように、高リスク患者はImpellaの使用でより完全な血行再建が可能となります。先日の木曜に公表されたSCAIガイドラインでは、「観察的研究から、高リスクの患者プロファイルにもかかわらず、MCS(機械的循環補助)装置が存在する場合、手術時の血行動態が改善され、血行再建がより完全になることが示されている」と指摘しています。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術またはバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国食品医薬品局(FDA)より市販前承認(PMA)を取得している心内留置型ポンプです。Impella 2.5、Impella CP、SmartAssist®搭載Impella CP、Impella 5.0®、Impella LD®、SmartAssist®搭載Impella 5.5™は、心原性ショック状態にある急性心不全心筋症患者の治療に使用する心臓ポンプとして米国食品医薬品局(FDA)の承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。Impella RP®は、右室不全および左心補助人工心臓の埋込、心筋梗塞、心臓移植、開胸手術後に発生する非代償性心不全の治療を目的として米国食品医薬品局(FDA)の承認を受けています。Impellaは、米国食品医薬品局(FDA)の歴史の中で最も研究された循環補助デバイスで、10年以上に及ぶFDAの研究、14万人以上の患者に関する実臨床データ、650本以上の査読付き論文が存在します。
欧州でImpella 2.5、Impella CP、SmartAssist搭載Impella CPは、高リスクPCIおよび心原性ショックショックを伴う急性心筋梗塞(AMI)の患者さんの最長5日間の治療を対象としてCEマークを取得しています。Impella 5.0およびImpella LDは、心原性ショックを伴う心臓発作または心筋症の患者さんの最長10日間の治療を対象としてCEマークを取得しています。SmartAssist®搭載Impella 5.5™は、急性心不全または心原性ショックを伴う心筋症の患者さんの最長30日間の治療を対象としてCEマークを取得しています。Impella RPは、右心不全および左心補助人工心臓埋込、心筋梗塞、心臓移植、開胸術後に発生する代償不全に陥った心不全の治療デバイスとしてCEマークを取得しています。
承認された適応症や、デバイスの使用に伴う重要な安全性・リスク情報を含め、Impella心臓ポンププラットフォームの詳細については、www.impella.comをご覧ください。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、心臓のポンプ機能を補助することで心筋の負担を軽減し、その回復を目指しています。詳細情報については、www.abiomed.comをご覧ください。
Abiomed、Impella、Impella 2.5、Impella 5.0、Impella LD、Impella CP、Impella RP、Impella Connectは、アビオメッドの登録商標で、米国および一定の外国で登録されています。Impella BTR、Impella 5.5、Impella ECP、CVAD Study、DTU STEMI Study、SmartAssistはアビオメッドが商標登録出願中です。
将来見通しに関する記述
本リリースは、アビオメッドの既存製品および新製品の開発、営業活動による企業としての成長、将来的可能性、および行政当局による承認の見込みに関する記述等の将来の見通しに関する記述が含まれます。当社の実績は多くの要因によりこの将来の見通しに関する記述の中で記載とは大きく異なる可能性があり、それらの要因には、COVID-19の世界的流行病がもたらす影響の範囲・規模・期間、開発、試験、関連行政当局による承認に伴う不確定要素(将来の損失の可能性を含む)、さらには将来的な損失が生じる可能性、複雑な製造工程、高品質に関する要件、限られた供給源への依存、競争、技術的変更、行政規制、訴訟問題、今後の資金需要と追加資金の不確実性に加え、直近に提出したForm 10-Kの年次報告書とその後SECに提出・提供した書類を含め、証券取引委員会に提出した当社の報告書に記載されたその他のリスクおよび課題が含まれます。利用者は、本プレスリリースの発表日時点に述べられている将来の見通しに関するいかなる記述についても過度に依拠することのないようお願いいたします。当社は、本プレスリリースの発行日以降に発生する事象、または予想外の出来事の発生によって、見通しまたは予測など、当社の将来の業績に関する見通しを更新し、または修正する義務を負うものではありません。これらの訂正は、本リリースの日付以降に発生する出来事や状況を反映させたり、予想外の出来事を反映させたりする場合に行われる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2020年5月19日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。