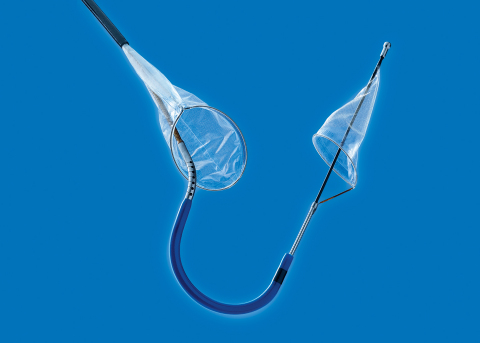
加州圣罗莎--(BUSINESS WIRE)--(美国商业资讯) -- Claret Medical®今天宣布,美国食品药品管理局(FDA)已按重新分类标准,核准该公司的Sentinel™脑保护系统(CPS)在美国上市发售。Sentinel是美国上市的首款且唯一可提供保护、免于卒中风险的器械,其机制是在经导管主动脉瓣膜置换术(TAVR)中脱落的碎屑到达脑部之前对其进行拦截和清除。枢纽性SENTINEL随机对照试验显示,使用Sentinel后,TAVR后最初72小时内的卒中降幅达63%,第90天时仍可维持显著差异1。
Claret Medical将即刻开始在全美TAVR手术台数高的各家示范中心发售该器械。公司还将携手Centers for Medicare and Medicaid Services (CMS),制订出获得新技术附加支付的途径,并已为Sentinel的报销建立了一个ICD编码。
TAVR是一种有效而常用的方法,通过微创手术置换病变的主动脉心脏瓣膜,但近期研究发现,每10例手术患者中,就有1例因该手术导致临床显著的卒中2。多数卒中发生于手术中或术后72小时内2,可能是本体心脏瓣膜或主动脉壁上松脱的碎屑游走至脑部所致,可能导致神经系统损害。
SENTINEL试验临床指导委员会主席、哥伦比亚大学医疗中心/纽约长老会医院的Martin Leon, MD表示:“卒中具有致残性,随机发生、无法预料,是所有TAVR患者及其经治医生最大的恐惧之一。临床医生所采取的任何减少脑损伤风险的措施都特别有临床意义。TAVR后最初72小时63%的临床卒中降幅,加上一个事实,即每4例患者中就有1例可采集到平均25块肉眼可见的碎屑,结果令人震惊。该器械可安全置放,手术时间延长很短,能发挥拦截栓塞性物质、减少缺血性脑损伤的预期性能。”
他继续表示:“在经导管脑栓塞保护的新时代,我们TAVR医生现在有责任通过共享决策流程,与患者和家属沟通这个信息,让他们知晓TAVR治疗选择。”
临床研究显示,在99%的TAVR病例中,无论采用何种类型的置换瓣膜,Sentinel均可清除流向脑部的可见碎屑,且不会增加风险2。Sentinel使用简便,置放成功率达99%,中位置放时间为4分钟2。它可远离主动脉弓安全置放,避免损伤主动脉弓的解剖结构,减少对TAVR导管的干扰,使医生只需专注于TAVR手术。
Claret Medical总裁兼首席执行官Azin Parhizgar博士表示:“‘受保护的TAVR’现在来临了,我们相信Sentinel将转变美国TAVR患者的治疗方式。该器械的科学依据已经为其他栓塞保护器械的达标设置了一个很高的标杆,其安全性记录无可置疑。通过帮助降低围手术期卒中的发生,我们希望患者和医生选择TAVR手术时能更加放心。”
Sentinel是 TAVR脑保护领域研究最为透彻的器械,已在多项研究逾1,000例患者中经过系统的评估,包括3项随机对照试验。迄今全球获得该器械保护的患者已逾3,500例,它是欧洲和部分亚洲国家唯一市售的脑保护系统,现在美国也包括在内。
关于Claret Medical
Claret Medical是一家私营公司,开发心脏及血管结构介入时脑保护创新解决方案。2011年以来,公司一直是脑保护领域的领先者,目前在欧洲拥有97%的市场份额。它是该类别中率先在美国市售的产品。欲了解Sentinel或公司的更多信息,请访问www.claretmedical.com。
| 1. |
SENTINEL试验数据,已纳入该器械的使用说明书(IFU)。欲浏览该IFU,请点击
此处。 |
|
| 2. | Kapadia S, Kodali S, Makkar R, et al. Protection against cerebral embolism during transcatheter aortic valve replacement. JACC. 2017 Jan 31; 69(4): 367-377(经导管主动脉瓣膜置换术中防止脑栓塞的保护措施。JACC. 2017年1月31日; 69(4): 367-377) |
免责声明:本公告之原文版本乃官方授权版本。译文仅供方便了解之用,烦请参照原文,原文版本乃唯一具法律效力之版本。